第三节 淋巴细胞及其亚群的分离
为研究免疫细胞的功能,常需高纯度的淋巴细胞或其亚群,分离方法介绍如下。
一、纯淋巴细胞群的采集
通常利用单核细胞在37℃和Ca2+存在条件下,能主动粘附在玻璃、塑料、尼龙毛、棉花纤维或葡聚糖凝胶的特性,据此建立许多从单个核细胞悬液中去除单核细胞的方法,藉以获得高纯度的淋巴细胞群。
(一)粘附贴壁法
将已制备的单个核细胞悬液倾于玻璃或塑料平皿或扁平小瓶中,移至37℃温箱静置1h左右,单核细胞和粒细胞均贴于平皿壁上,而未贴壁的非粘附细胞几乎为纯淋巴细胞,继用橡皮刮下贴壁的细胞即为纯单核细胞群。因B细胞也有贴壁现象,用本法分离的淋巴细胞群中B细胞有所损失。
(二)吸附柱过滤法
将单个核细胞悬液注入装有玻璃纤维或葡聚糖凝胶SephadexG10的柱层中,凡有粘附能力的细胞绝大部分被吸附而粘滞在柱层中,从柱上洗脱下来的细胞主要是淋巴细胞。此法简单易行,对细胞极少损害。
(三)磁铁吸引法
利用单核细胞具有吞噬的特性,在单个核细胞悬液中加直径为3μm的羰基铁颗粒,置37℃温箱内短时旋转摇动,待单核细胞充分吞噬羰基铁颗粒后,用磁铁将细胞吸至管底,上层液中含较纯的淋巴细胞。
二、淋巴细胞亚群的分离
分离相当纯化的淋巴细胞亚群是细胞免疫检验的基本技术。其原则是根据相应细胞的特性和不同的标志加以选择性纯化。凡根据细胞的特性和标志选择纯化所需细胞的方法是阳性选择法;而选择性去除不要的细胞,仅留下所需的细胞是为阴性选择。常用以下几种方法:
(一)E花环沉降法
本法是将淋巴细胞与一定比例的绵羊红细胞混合,待淋巴细胞形成E花环后,继用淋巴细胞分层液分离细胞。浮悬在分层界面而不形成E花环的群则富含B细胞,而沉降在管底的形成E花环的细胞用低渗法处理,使围绕细胞周围的绵羊红细胞快速裂解,则获得纯的T细胞。
(二)尼龙毛分离法
本法利用B细胞和单核细胞具有易粘附于尼龙纤维表面的特性,可将T和B细胞分开。操作原则是取松散而经过处理的尼龙毛(聚酰胺纤维),均匀充填在内径5~6nm的聚乙烯塑料管(饮料管即可)内,经Hanks液浸透保温,将单个核细胞悬液加入柱内,放37温箱静置1~2h。用预温的含10%~20%小牛血清培养液灌洗,洗脱液内含有非粘附的T细胞,重复灌洗几次以除去管内残留的T细胞。再用冷或温培养液边冲边洗边挤压塑料管,此时洗脱液内富含B细胞。如此得到的T细胞纯度在90%以上,B细胞纯度可达80%。
(三)亲和板结合分离法
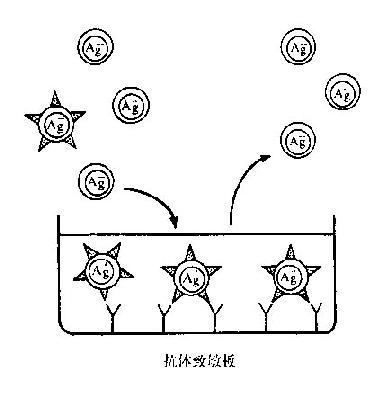
利用亲和层析法分离淋巴细胞亚群,其原理是各种淋巴细胞亚群具有不同的抗原性,将相应抗体结合于塑料平板上,继加细胞悬液,凡抗原阳性的细胞则与相应抗体结合,抗原阴性的细胞可从未吸附的细胞悬液中获取(图20-3)。同样若用特异性抗原交联在塑料板上,则可分离得具有特异抗原受体的淋巴细胞。淋巴细胞受体与特异抗原或抗体接触,可引起细胞激活,因此,凡欲去除细胞悬液内某一细胞亚群时,本法更适用。如要分离CD4+或CD8+细胞,则可用抗CD4或CD8单克隆抗体吸附。用抗Ig抗体则可分离B细胞。同样,用活化的C3包被,可分离出有C3受体的细胞。

图20-3 亲和分离法图解
(四)荧光激活细胞分离仪分离法
荧光激活细胞分离仪(fluorescenceactivatedcellsorter,FACS)主要由4部分组成:①细胞流动系统及气压流速控制系统,②激光系统,③检测与讯号处理系统,④细胞分选系统。其主要原理是细胞经荧光染色后,通过高速流动系统,细胞排成单行,逐个流经检测区进行测定。当细胞从流动室喷嘴处流出时,超声振荡搅动液流,使液流断裂成一连串的均匀小滴(40000个/s),每小滴内最多含一个细胞(其中只有百分之几的液滴中含细胞),细胞经激光束照射产生荧光和散射光,由光电倍增管接收,转换成脉冲信号,数据经电脑处理,分辨细胞的类型。如识别的是预计所需的细胞时(如T细胞、B细胞要其亚群),在细胞样品流断裂成小滴时,使液滴瞬即感应阳电荷、阴电荷或不带电荷,使所需的细胞在电场偏转下进入不同的收集管(图20-4)。用FACS分离细胞准确快速,能保持细胞活力,并可在无菌条件下进行,但仪器昂贵,极少用于常规,而多数仅作为研究的手段。
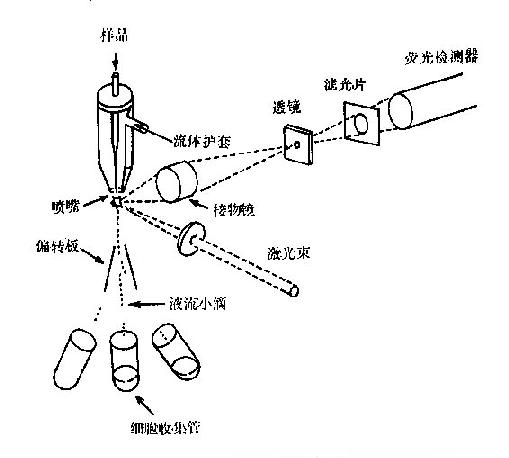
图20-4 荧光激活细胞分离仪简图