第十章 免疫原和抗血清的制备
抗原和抗体是免疫学检验的两大重要因素,也是整个免疫反应的基本条件。抗原的纯化是制备特异性抗的先决条件,制得的抗体可用于纯化抗原和检测抗原。抗体有单克隆和多克隆两类。
单克隆抗体用杂交瘤技术制备(详见第十一章),多克隆抗体存在于免疫动物抗血清中。近年来又出现了基因工程抗体(单链抗体)。本章仅叙述抗原纯化和多克隆抗血清制备技术。
第一节 免疫原的制备
免疫原是诱导机体产生抗体、并能与抗体发生反应的物质。能否制得合格的抗体由许多因素决定,而能否制备合格的免疫原则是其前提条件。而且作为诊断试剂的抗原也必须是单一特异性的,即纯化的抗原。自然众多的物质皆可成为免疫原,但绝少是单一成分(除非是合成的基因工程制备的),所以必须将某个抗原从复杂的组分中提取出单一的成分。下面介绍有代表性的免疫原制备方法。
一、颗粒性抗原的制备
颗粒性抗原主要是指细胞抗原或细菌抗原。最常用的细胞抗原为制备溶血素用的绵羊红细胞。这种抗原制备比较简单,采集新鲜绵羊红细胞,以无菌盐水洗涤3次(每次离心2000r/min10min),最后配成106/ml浓度的细胞悬液,即可应用。细菌抗原多用液体或固体培养物经集菌后处理。H抗原用有动力的菌株,菌液用0.3%~0.5%甲醛处理,而O抗原则需要100℃加温2~2.5h后应用。Vi抗原则应在杀菌后再加0.5%~1%氯化钙溶液。有时虫卵也可做成抗原,如日本血吸虫卵抗原可制成悬液供免疫用。有些细胞膜成分,如组织细胞膜、血细胞膜经打碎后亦可制成颗粒抗原。颗粒抗原悬液呈乳浊状,多采用静脉内免疫法,较少使用佐剂作皮内注射。
二、可溶性抗原的制备和纯化
蛋白质、糖蛋白、脂蛋白、细菌毒素、酶、补体等皆为良好的可溶抗原。但因这些蛋白质多为复杂的蛋白组分,免疫前需进行纯化。蛋白质纯化方法在生物化学技术中已有详述,本章主要介绍免疫化学纯化方法。
(一)组织和细胞粗抗原的制备
免疫原多来源于只类及动物的组织或细胞,这些材料在取得可溶性蛋白质之前,必须先进行处理,以适合于进一步纯化。
1.组织细胞抗原的制备所用组织必须是新鲜的或低温(<-40℃)保存的。器官或组织得到后立即去除表面的包膜或结缔组织以及一些大血管。如有条件,脏器应进行灌注,除去血管内残留的血液。处理好的组织用0.05/NaN3生理盐水洗去血迹及污染物。将洗净的组织剪成小块,进行粉碎。粉碎的方法有两类:①高速组捣碎机法。操作时,将组织加盐水(约1/2)装入捣碎机筒内,用高速(约1000r/min)间断进行,每次30~60s,时间过长会产热。②研磨法。可用玻璃匀浆器或乳钵研磨。玻璃匀浆器是由一内壁经过磨砂的玻璃管和一根一端为圆柱状(表面亦经磨砂)的磨杆组成,主要经过旋转、压挤将组织粉粹。研磨法可用于韧性较大听组织,如皮肤、空腔器官等。为了更有效地磨碎组织,有时在研磨时加入淘洗过的海砂。组织匀浆通过2000~3000r/min离心10min后分成两个部分:沉淀物含有大量的组织细胞和碎片;上清液作为提取可溶性抗原的材料,提取前还要通过1000~2000r/min20~30min的高速离心,以除去微小的细胞碎片,此时上清液应澄清。
2.组织细胞或培养细胞可溶性抗原的制备制备抗原用的细胞包括正常细胞、病理细胞(如肿瘤细胞)或传代细胞。组织细胞的制备一般通过上述机械破碎后取得。或通过酶消化,所用的酶大多为胃蛋白酶或胰酶。通过酶解将细胞间质蛋白消化,获得游离的单个细胞。细胞抗原一般分为三个组分:膜蛋白抗原、细胞浆抗原(主要为细胞器)和细胞核及核膜抗原。三种抗原的制备皆需将细胞破碎,方法有如下几种。
(1)反复冻融法:将待破碎的细胞(有时为整块组织)置-20冰箱内冻结,然后缓慢地融化。如此反复2次,大部分组织细胞及细胞内的颗粒可被融破。
(二)冷热交替法:在细菌或病毒中提取蛋白质及核酸时可用此法。操作时,将材料投入沸水浴中,90℃左右维持数分钟,立即置于冰浴中使之迅速冷却,绝大部分细胞被破坏。
(3)超声破碎法:对微生物和组织细胞多用此法。处理效果与样品浓度和使用频率有关。一般组织细胞皆易破碎,而细菌,尤其是真菌的厚膜孢子则较难打破。超声波所使用的频率从1~20kHz不等。同样要间歇进行,因长时间超声也会产热,易导致抗原破坏。一次超声1~2min,总时间为10~15min。
(4)自溶法:利用组织和微生物的自身酶系,在一定的pH和温度下,使其细胞裂解。自溶的温度,对动物组织细胞常选0~4℃,而对微生物常选室温。自溶时常需加入少量防腐剂,如甲苯或氯仿等,NaN3不宜使用,因其能抑制酶的活力。
(5)溶菌酶处理法:在碱性条件下(pH8.0),溶菌酶可专一破坏细菌细胞壁,适用于多种微生物。除溶菌酶外,蜗牛酶、纤维素酶等也可用于消化细菌和组织细胞。
(6)表面活性剂处理法:常用的有十二烷基吡啶、支氧胆酸钠等。因效果较差,已少应用。
(二)超速离心和梯度密度离心法
超速离心是分离亚细胞及蛋白质大分子的有效手段,往往是进一步纯化的第一次过筛。超速离心又分差速离心和梯度离心。差速离心系指低速与高速离心交替进行,用于分离大小差别较大的颗粒。梯度密度离心是一种区带分离法,通过梯度密度来维持重力的稳定性。通过离心,沉淀的颗粒比液体的比重大,漂浮的颗粒比液体的比重小。通常待分离的悬液中的颗粒比液体重,假如要使之上浮,必须加入第三种成分,使其密度连续或不连续地升高,形成所谓梯度。第三种成分多用甘油、蔗糖、氯化铯或氯化铷等。假如梯度柱的范围所表现的密度同待分离颗粒的密度大致相等时,则经过较长时间离心可得到分离。这种方法称为密度离心或梯度离心。
用超速离心或梯度离心分离和纯化抗原只是一种根据抗原的比重特点分离的方法,除个别成分外,极难将某一抗原成分分离出来。目前仅用于少部分大分子抗原,如IgM、C1q、甲状腺球蛋白等,以及一些比重较轻的抗原物质如载脂蛋白A、B等。对于大量的中、小分子量蛋白质,多不适宜用超速及梯度密度离心作为纯化手段。
(三)选择性沉淀法
选择性沉淀是采用各种沉淀剂或改变某些条件促使抗原成分沉淀,从而达到纯化的目的。
1.核酸去除法从微生物或细胞提取蛋白质抗原时,其中常含有大量核酸成分。除去核酸可用提取沉淀剂,如氯化锰、硫酸鱼精蛋白或链霉素等。核糖核酸降解法较为简便,用DNA或RNA酶与提取液共同作用30~60min(4℃),即可有效地除去核酸成分。
2.盐析沉淀法这是最古老而又经典的蛋白质纯化分离动技术。由于方法简便、有效、不损害抗原活性等优点,至今仍被广泛应用。
(1)抗原的粗筛:用不同饱和度的硫酸铵或硫酸钠可将一个复杂的组织液吩成若干组分,也可收集某一饱和度的盐析沉淀物作为进一步纯化的粗筛物。最常用的盐析剂是33%~50%饱和度的硫酸铵。
(2)提取丙种球蛋白:丙种球蛋白主要为IgG(95%以上)。将35%~40%饱和度的硫酸铵沉淀物经去盐后可直接用于某些试验作为抗体试剂。此法简单、稳定、固收率高,已成为免疫化学试验的常规方法。
(3)抗原的浓缩:在液体中含量较少的抗原,如尿中的游离轻链及离子交换层析洗脱液中的抗原,可通过加入硫酸铵,将其沉淀下来,以利进一步纯化。
3.有机溶剂沉淀法有机溶剂以降低溶液的介电常数,从而增加蛋白质分子上不同电荷的引力,导致溶解度降低。另外,有机溶剂与水作用,能破坏蛋白质的水化膜,故蛋白质在一定浓度的有机溶剂中被沉淀析出。使用的有机溶剂多为乙醇和丙酮。高浓度的有机溶剂易引起蛋白质变性、失活、操作必须在低温下进行。Cohn(1942)低温酒精沉淀法可将血浆蛋白分为5个组分,IgG属于Cohn-3组分。
4.水溶性非离子型聚合物沉淀法常用的聚合物为聚乙二醇(PEG)及硫酸葡聚糖。水溶性聚合物沉淀蛋白质的机制尚不清楚,大致有如下解释:①聚合物与蛋白质形成共沉物;①聚合物与蛋白质之间发生水的重分配;①聚合物与蛋白质形成复合物。此法受许多因素影响,主要是pH、离子强度、蛋白质浓度和PEG的分子量等。分子量为2000~6000的PEG皆适宜于做蛋白沉淀用。如若使用得当,效果甚为满意。一般认为,PEG浓度在3%~4%时沉淀免疫复合物,6%~7%可沉淀IgM,8%~12%可沉淀IgG,12%~15%可沉淀其他球蛋白,25%可沉淀白蛋白。最突出的应用是用3%~4%的PEG沉淀免疫复合物,未结合的抗原和抗体留在溶液中。按此原理设计了快速测定法和循环免疫复合物测定法。
(四)凝胶过滤和离子交换层析
凝胶过滤又名分子筛层析,利用微孔凝胶,将不同分子量的成分分离。离子交换层析是利用一些带离子基团的纤维素或凝胶,吸附交换带相反电荷的蛋白质抗原,将蛋白质抗原按带电荷不同或量的差异分成不同的组分。这两种层析如能共同应用或者反复应用其中的一种,皆可将某一蛋白质从一复杂的组分中纯化出来。
(五)亲和层析
上面介绍的各种纯方法主要是依赖抗原的物理和化学特性,如分子量、携带电荷等,经过纯化后只能取得相同性质的物质,在免疫特性上是否为同种物质还不能肯定。亲和层析是利用生物大分子的生物学特异性,即生物分子间所具有的专一性亲和力而设计的层析技术。例如抗原和抗体、酶和酶抑制剂(或配体)、酶蛋白和辅酶、激素和受体等之间有一种特殊的亲和力,在一定条件下,它们能紧密地结合成复合物。如果将复合物的一方固定在不溶性载体上,则可从溶液中专一地分离和提纯另一方。与上述其他纯化方法相比,亲和层析能产生相当高的纯化作用。另外,此法的优点是迅速,有时仅一步即可达到纯化的目的。
1.亲和层析支持物的选择作为亲和层析支持物须符合以下要求:①非特异性吸附低;②液体通过时流速要快;③在各种pH和高浓度盐溶液中稳定;④必须有合适的、丰富的化学基团,能有效地与蛋白质或其它化合物结合;⑤必须带有丰富的微孔,以增加结合容量。符合以上5个条件的支持物有琼脂糖、聚丙烯酰胺和多孔玻璃球,其中常用的是琼脂糖珠(Sepharose2B、4B、6B)。
2.配体的选择所谓配体系指具有亲和性的双方,作为免疫亲和层析专指抗原与抗体。良好的配体必须具备以下3个条件。
(1)抗原或抗体必须单一特异性:抗原或抗体的纯化效果决定于固相中配体的纯度。
(2)抗原与抗体之间必须有强的亲和力:这种亲和力决定于抗原决定簇的性质和数量。对抗体来说还决定于抗体来源动物的种类和免疫时间,如马抗血清亲和力较低,免疫血清亲和力较高;免疫时间短的亲和力低。但是,亲和力太强也不利,因为解离抗原抗体复合物所需要的条件就要强烈,从而可造成蛋白质的变性。例如用低pH(1.5~2.5)或高盐(如6mol/L盐酸胍)可使部分抗原或抗体活性降低或丧失。
(3)配体必须有一个适当的化学基团,这个基团不参与配体和大分子的特异结合,但可用来连接支持物,而且这种连接不应当影响配体与大分子结合的亲和性。
3.抗原或抗体与支持物的结合将抗原或抗体结合到支持物上的方法目前有20多种,但可归结为载体结合法、物理吸附法、交联法和网络法4类。
结合法的一般步骤是先活化支持物上的功能基团,然后将抗原或抗体连接到这些活化的基团上。用来发生交联的化学反应必须足够温和,不致使抗原或抗体遭到破坏。交联后,要彻底清洗支持物,以除去剩下的未交联的物质。
最常用的支持物是Separose4B,将此支持物与溴化氰在pH11时进行处理,则能使支持物活化。此时溴化氰与支持物上的羟式反应形成氨基甲酸酯基团。加入溴化氰的量取决于支持物的量。如果希望取代程度提高,则加入溴化氰的量也要提高。交联时首先要注意加入抗原或抗体的浓度。通常在交联反应混合物中的交联蛋白质浓度应是亲和分离浓度的20~30倍。这样,溴化氰浓度也必须提高到200mg/ml凝胶。若希望最终产物含量较少,所加入的溴化氰也应减少。交联时的pH也应注意,pH9.5~10时,活化的琼脂糖珠很不稳定。降低pH,也就减少了能反应的配体浓度,交联量就会减少。
亲和层析中常用小分子抗原或其它化合物与支持物交联,由于载体空间的位阻而影响了与抗原或其它亲和物的结合,产生了所谓的无效吸附。另外,Sepharose4B交联时要求有一游离的氨基,如果该抗原有具氨基则难于交联。基于这两个原因,通常在琼脂糖与抗原之间接上不同长度的“手臂”。必要时这些“手臂”末端可接上游离氨基,以与不带氨基的配基偶联。常用的带“手臂”琼脂糖有氨基琼脂糖(二亚胺)、羧基琼脂糖(琥珀酸酐)、溴乙酰琼脂糖(0-溴乙酰-N-羧基琥珀酰胺)、重氮盐衍生物琼脂糖和疏基琼脂糖等。这些带“手臂”的琼脂糖有商品供应,使用极为方便。
4.亲和层析条件的选择
(1)支持物与抗原或抗体结合后,还可能有多余的活性基团,为了封闭这些残基团,必须用无关蛋白质或三乙醇胺过一次柱,以封闭活性基团。
(2)去掉未结合及结合不牢固的蛋白质。先用0.2mol/LNaHCO2(含0.1mol/LNaC1,pH9.0)洗脱2~3个柱体积,再用解脱剂处理一次亲和层析柱。
(3)解脱剂有多种。常用的有0.2mol/LpH2.8甘氨酸-HC1缓冲液、0.1mol/LpH2.4甘氨酸缓冲液、7mol/L脲、5mol/LNaI、3mol/L硫氰酸钾(或钠)、1mol/L乙酸、6mol/L盐酸胍、0.2mol/LKC1等。作为抗原抗体解脱剂,最多用的是3mol/L硫氰酸钾(或钠)及0.1mol/LpH2.4甘氨酸缓冲液。
(六)免疫球蛋白片段的制备
免疫球蛋白具有抗原性,可用以免疫动物制备相应的抗体,而这种抗体常用于免疫球蛋白的检测。五类免疫球蛋白皆可用前面介绍的纯化方法提取出来。如将这些免疫球蛋白分解成片段,如Fc段、Fab段、轻链等作为免疫原制备抗血清,则可制得分辨能力更高的特异性抗体。制备方法如下:
1.温和条件析离亚单位亚单位之间以非共价键、如氢键、静电引力等连接起来,这些键结合力较弱,可经2种方法将其断开制备片段。第一种方法是改变pH,一般将pH调至3~4(羧基滴定范围)和9~10(赖氨酸-酪氨酸滴定范围),当低于3或高于10时,亚单位会离解。这个方法是利用强变性剂,如8mol/L盐酸胍等。用此可以将亚单位分开。这个方法也用于载脂蛋白抗原的解离和胶原肽的提取。
2.二硫键的解离二硫键是连接Ig肽链的共价键,解离二硫键可将轻链与重链分开。解离的方法多采用氧化法和还原法。氧化法的优点是切开后,肽链不能重新形成二硫键,便于肽链纯化;缺点是甲硫氨酸被氧化成亚砜,色氨酸侧链被破坏。还原法是将二硫键还原成巯基。但这个疏基极不稳定,易再重新结合成二硫键,必须及时用碘乙酸或碘代乙酰胺进行羧甲基化。
3.溴化氰裂解法溴化氰与蛋白质中的甲硫氨酸侧链的硫醚基起反应,生成溴化亚氨内酯。此产物与水反应,将肽链断裂。
4.酶裂解法因为酶解有极好的专一性,不同的片段可用不同的酶裂解。如木瓜酶可将IgG裂解成Fc和Fab(×2)3个片段,胃蛋白酶可将IgG解成F(ab')2和几个小肽段,胰蛋白酶则将其切成不规则的肽链。作为抗原制备常用木瓜酶切断,取得Fc段,以制备抗链血清。作为抗体试剂应用,常用胃蛋白酶切断取得F(ab')2。
(七)纯化抗原的鉴定
纯化抗原的鉴定方法较多,常用的有聚丙烯酰胺凝胶电泳法、结晶法、免疫电泳法、免疫双扩散法等。事实上,仅用一种方法还无法作纯度鉴定,只有几种方法联合应用才较可靠。结晶法不是纯度的标准,因结晶中往往含有其它成分。电泳谱中呈现单一区带也不能排除在这条带中含有其他成分。有时虽出现几条带,也可能是同一物质的聚合体或降解物。
蛋白抗原的定量可用生化分析中的常用方法。根据测试抗原量的多少可用双缩脲法或酚试剂法。如果抗原极为宝贵,可用紫外光吸收法。
三、半抗原免疫原的制备
多肽、甾族激素、药物、脂肪胺、核苷等小分子物质仅能与相应的抗体发生特异性结合反应,而它们自己并不是免疫原,不能诱导抗体产生。只有将这种半抗原与蛋白质或其他高聚物结合后才能刺激机体产生抗体。结合的方法有物理法和化学法。物理吸附的载体有淀粉、聚乙烯吡咯烷酮(PVP),硫酸葡聚糖、羧甲基纤维素等,是通过电荷和微孔吸附半抗原。化学法是利用功能团把半抗原以载体上。
(一)载体选择
1.蛋白质类蛋白质是结构复杂的大分子胶体物质,是一种良好的载体。常用的有人血清白蛋白、牛血清白蛋白、牛甲状腺球蛋白和血蓝蛋白等。其中以牛血清蛋白最为常用,因其溶解度大,免疫活性强,又容易获得。蛋白质和半抗原结合是通过游离氧基、游离羧基、酚基、巯基、咪唑基、吲哚基和胍基等活性基团的缩合。
2.多肽类聚合物是人工合成的多肽聚合物,常用的是多聚赖氨酸(polylysine)。这种多聚合物与半抗原结合后,可诱发动物产生高滴度、高亲和力的抗体。多聚赖氨酸的分子量可达十几万到几十万,是良好的载体。
3.大分子聚合物和某些颗粒PVP、羧甲基纤维素和活性碳等皆可与半抗原结合,加入福氏完全佐剂可诱发产生良好的抗体。
因半抗原种类、动物类别、载体种类及结合方法的不同,制得的免疫原对动物免疫所产生的效果也不同。实际应用时,应多采用几种载体或方法。
(二)连接方法
半抗原与载体连接要掌握3个基本条件:带游离氨基或游离羧基以及二种基团皆有的半抗原,如多肽激素类(脑啡肽、胃泌素、ACTH、前列腺素等),它们有游离的氨基或羧基。羧基可用混合酸酐法和碳化二亚胺法与载体氨基形成稳定的肽键。同样,带氨基的半抗原则可与载体羧基缩合。亦可用双功能试剂如戊二醛、甲苯2,4-二异酸盐与载体氨基连接。脂肪胺可用碳化二亚胺缩合剂或对硝基苯酰氯反应,把脂肪胺变为对硝基苯酰胺,通过加氢还原为氨基苯酰衍生物,再用重氮化反应。②带有羟基、酮基、醛基的半抗原,如醇、酚、糖、多糖、核苷以及甾族激素等,它们都不能直接与载体连接,需要用化学方法在半抗原上引起羧基后才能与载体连接。③芳香族半抗原由于环上带有羧基,它邻位上的氢很活泼,极易取代。
半抗原和载体连接的方法在一般实验室皆可完成,但反应条件应严格要求,以防半抗原失活或载体严重变性(一般变性并不妨碍)。
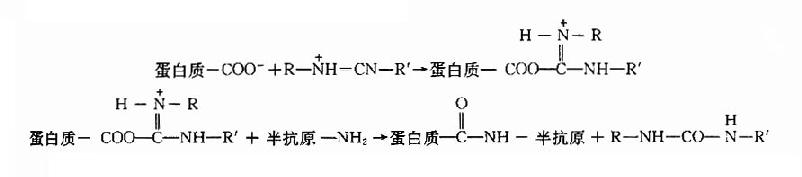
1.碳化二亚胺法碳化二亚胺是一种化学性质非常活泼的双功能试剂,常用的水溶性碳化二亚胺化学名为1-乙基-3-(3-二甲氨基)-碳化二亚胺盐酸盐。它可与半抗原的羧基、也可与其氨基结合,反应如下:+

此连接方法十分简便,只需将载体蛋白质和抗原按一定比例混合在适当的溶液中,然后加入水溶性碳化二亚胺,搅拌1~2h,置室温24h,再经透析即可。
2.戊二醛法戊二醛也是常用的双功能交联剂,它借两端的醛基与载体和半抗原的氨基以共价键连接,其反应如下:
蛋白质-NH2+半抗原-NH2+COH-(CH2)3-COH→蛋白质-N=CH-(CH2)3-CH=N-半抗原
3.氯甲酸异丁酯法该法又称为混合酸酐法,是利用半抗原上的羧基和载体蛋白上的氨基以肽链相连接,方法简便,多用于类固醇抗原的制备,其反应如下:

(三)无羧基和氨基半抗原衍生物的制备
某些类固醇和药物,需加以适当的改造,使其转变为带有羧基或氨基的衍生物。依据半抗原的性质有如下4种方法。
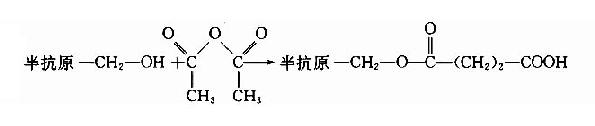
1.琥珀酸酐法琥珀酸酐是琥珀酸的脱水产物,遇水又可恢复。如果将带有羟基的半抗原化合物和琥珀酸酐在无水的吡淀中反应,就可得到带有羧基的半抗原琥珀酸的衍生物。再经碳化二亚胺可氯甲酸异丁酯法,制备载体半抗原。制备衍生物的反应如下:
2.O-(羧甲基)羧胺法带有酮基的半抗原与O-(羧甲基)羟反应,转变为带有羧基的半抗原衍生物。反应式如下:
半抗原-C=O+H2N-O-CH2COOH→半抗原-C=N=O=CH2-COOH
3.一氯醋钠法带有酚基的半抗原,可用一氯醋酸钠法,生成带有羧基的半抗原衍生物。其反应式如下:
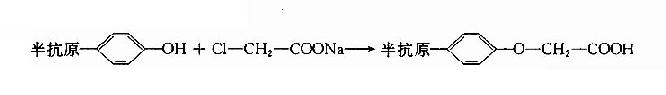
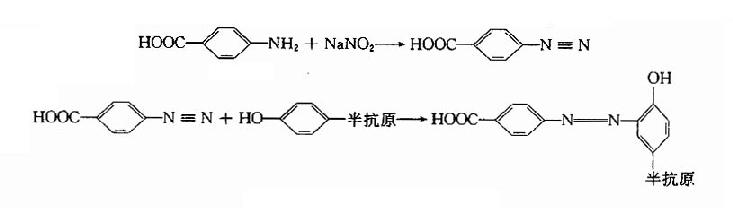
4.重氮的对氨基苯甲酸法先将对氨基苯甲酸和亚硝酸钠反应,反应产生再作用于带有酚基的半抗原,获得带有羧基的半抗原衍生物。反应式如下:
四、佐剂
为了促进抗体产生,可在注射抗原的同时,加入一种辅助剂,这种辅助剂称为佐剂。佐剂本身可以有免疫原性,也可不具备免疫原性。常用的有免疫原性的佐剂有百日咳杆菌、革兰阴性杆菌的内毒素和抗酸杆菌(包括结核分枝杆菌和枯草分枝杆菌)等;非抗原性的佐剂有铝乳、磷酸钙、石蜡油、羊毛脂、表面活性剂、藻酸钙、聚核苷酸、胞壁肽等。应用最多的是福氏(Freund)佐剂,是用石蜡油、羊毛脂和卡介苗混合而成。
佐剂的作用机制极为复杂。在佐剂-抗原的注射部位,可见到细胞浸润,几天后,局部形成肉芽肿(细胞免疫反应)。起初,反应部位以肉芽组织为主,以后则见多量巨噬细胞、浆细胞、巨细胞、类上皮细胞。局部淋巴结和脾中也可见大量浆细胞,提示佐剂可以直接刺激参与免疫反应的细胞并使之增生。有许多佐剂如内毒素、分枝杆菌、小棒状杆菌、聚核苷酸、皂素等对细胞膜有活化作用,它们可增加巨噬细胞和淋巴细胞的细胞通透性,促进了对抗原的有效处理。佐剂一般是乳剂或悬液,当与水溶液抗原混合后形成一种油包水或水包油的乳状颗粒,这种颗粒延缓了抗原的吸引,增加了局部刺激作用。
另有报告,佐剂和抗原混在一起注射可以改变抗原的分布。应用核素标记的合成多肽或沙门氏菌鞭毛抗原与福氏佐剂混合注入大鼠或豚鼠后肢足掌,测定局部引流淋巴结、脾和血清中的抗原含量,发现它可明显地延长抗原从局部吸收的时间。对于低分子量的多肽,这一作用较为短暂,而对于鞭毛抗原,这一作用十分明显。虽然吸收被延缓,但在淋巴结和脾中,抗原的含量都明显高于不用佐剂的动物。这提示,抗原与佐剂同时应用,可促进抗原在淋巴组织中存留。
福氏佐剂分为不完全佐剂(石蜡油+羊毛脂)和完全佐剂(石蜡油+羊毛脂+卡介苗)。佐剂和抗原的比例为1:1。由于佐剂是油剂,加入抗原后要充分混合成乳剂。混合的方法有2种,一为研磨法,二为搅拌混合法。研磨法用一乳钵(玻璃或玛瑙),先将佐剂加热倾入,待冷却后加入卡介苗(2~20mg/ml),再逐滴加入抗原,边滴边加速研磨,直至完全变为乳剂为止。另一种方法是用两个5ml注射器,在接针头处用一尼龙管连通,一个注射器内是佐剂,另一注射器内为抗原。装好后来回推注,经多次混合逐渐变为乳剂。本法优点是无菌操作,节省抗原或估剂,用此注射器可直接注射;缺点是不易乳化完全。乳化完全与否的鉴定方法是将一滴乳剂滴入水中,如立即散开,则未乳化好,如不散开漂在水面则为乳化完全。
为了防止感染,有时在佐剂中加入抗生素。但抗生素有免疫抑制作用,如能注意无菌操作,就不必加入。