6.6 钾
钾占人体无机盐的5%,是人体必需的营养素。
6.6.1 体内的分布
一切细胞都含有钾。它可以反映细胞质量。体钾含量(mmol·kg-1体重):儿童平均为4.0,成年男子为45~55,妇女为32。体钾总量(mmol):成年男子约3200,妇女为2300,老年男子为2800,妇女2100。用多种同位素测定人体可交换钾(Ke)为149mmol,可交换钠(Nae)为55mmol。随着年龄的增加,Ke和Ke/Nae比值都下降。钾漏到细胞外可能是细胞老化的一个因素。
钾在体内的分布与器官的大小及其细胞的数量和质量有关,也受醛固醇影响。70%的体钾储存在肌肉,10%在皮肤,其余在红细胞、脑髓和大型内脏中,骨骼中较少。
细胞内平均钾浓度为150mmol·L-1,比细胞外高25~35倍,除离子态外,一部分与蛋白质的结合,一部分与糖、磷酸盐相结合。胞外钾主要以离子态存在,含量少。血浆平均含钾5mmol·L-1(3.5~5.5mmol·L+1)。细胞内外的钾不断地交换,达到平衡约需15h。
6.6.2 生理功用
钾是生长必需的元素,是细胞内的主要阳离子,维持细胞内液的渗透压。它和细胞外钠合作,激活钠-钾-ATP酶,产生能量,维持细胞内外钾钠离子的浓差梯度,发生膜电位,使膜有电信号能力。膜去极化时在轴突发生动作电位,激活肌肉纤维收缩并引起突触释放神经递质。钾维持神经肌肉的应激性和正常功能。
钾营养肌肉组织,尤其是心肌。它协同钙和镁维持心脏正常功能。通过钾-钠-ATP酶,钾维持以肌的自律性、传导性和兴奋性,影响心房T波。许多儿童因腹泻、蛋白质严重缺乏而突然死亡的原因,主要是失钾引起的心力衰竭所致。
钾参与细胞的新陈代谢和酶促反应。葡萄糖变成糖原储存于肝、氨基酸合成肌肉蛋白、ADP变成ATP、血中糖和乳酸的消长,钾在其中均起催化作用。它使体内保持适当的碱性,有助于皮肤的健康,维持酸碱平衡。每日PH升降0.1,则血浆钾浓度升约0.6mmol·L-1(0.4~1.2mmol·L-1)。
钾与钠是对抗的。当2个Na+和1个H+进入细胞时,就有3个K+移到细胞外。当体内需要保钠和水时,在肾远曲小管里排出1个K+换回1个Na+。钾对水和体液平衡起调节作用。钾能对抗食盐引起的高血压。原发性高血压病人尿中钾排出量比正常人低。钾对轻症高血压及有高血压因素的某些正常血压者有降压作用。它通过利尿、降低肾素释放、扩张血管,提高钠-钾-ATP酶的活力以改善水钠的潴留,因而使血压下降。
6.6.3 钾的代谢
人体的钾主要来自食物。豆、瘦肉、乳、蛋、马铃薯、绿叶蔬菜、茶叶、向日葵子、谷物、水果如香蕉、橘子、柠檬、杏梅等含钾丰富。成年人从膳食中摄入钾量为60~100mmol·d-1,儿童为0.5~3.00mmol·kg体重-1+·d-1。
钾大部分由小肠迅速吸收,在结肠中主动运输,近端结肠中主动分泌,远端结肠中主动吸收。肠腔的钾浓度随摄入量而变化。在正常情况下,摄入量的85%经肾排出,10%左右从粪便排出,其余少量由汗排出。
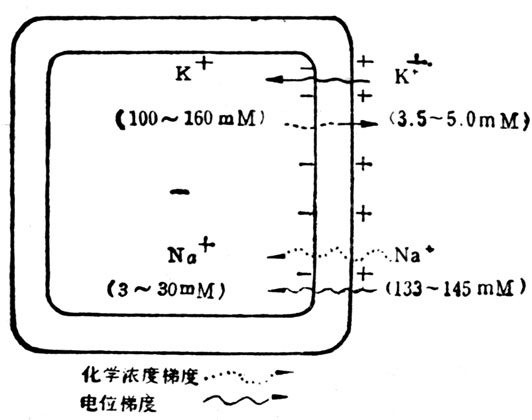
(1)钠-钾-ATP酶白的能量需要 细胞产生能量,维持细胞内K+离子在高浓度(100~160Mm),Na+离子在低浓度(3~30Mm),而在细胞外面则相反,钾离子浓度低(3.5~5.5mM),钠离子浓度高(133~145Mm)(图6-5)。Na+和K+离子浓度梯度移动,Na+离子逆着约-70mV的电位移动,维持着这种梯度。细胞内的Na+离子主动运过半透膜,偶联交换细胞外的K+离子,带负电荷的蛋白质不能通过细胞膜,结果这些离子分布不均匀因此发电。向外移动的钠离子比向内移动的钾离子多,3个钠换2个钾,故产生净电荷。细胞膜上的Na+-K+ATP酶负责主动运输这些离子。

图6-5 细胞中化学浓度梯度和电位梯度
离子与酶的带电荷部分相互作用,与此同时酶分子结构发生构象变化。ATP水解,给主动运输供应能量,钠离子引起磷酸体作用发生周期性的变化,钾离子调节磷酸根的水解。目前对钠泵主运输离子的机理有许多解释,上述是多数人接受的一种解释。
(2)钾代谢的抑制剂 Na+-K+-ATP酶,不抑制剂:哇巴因(Ouabain)和钒酸盐类。无论在生理上或药理上,这两个抑制剂都很重要。
①哇巴西:特异性地抑制Na+-K+-ATP酶。它抑制酶的结合ATP和磷酸中间体的脱磷酸作用,抑制细胞的排钙,从而使细胞内钙离子浓度升高,解发肌动蛋白-肌凝蛋白调节的心肌收缩。降低细胞外钾浓度(低钾血症)可增强这种作用,而高钾血症或降低细胞内离子浓度则抑制这种作用。
②钒酸盐:在浆膜侧抑制Na+-K+-ATP酶,当细胞外K+离子浓度大于5mM或Na+离子浓度降低时,钒酸盐的抑制作用增强,间接作用竟争ATP磷酸化的位置。除了抑制Na+-K+-ATP酶以外,钒酸盐还抑制Ca2+-Mg2+-ATP酶、膜外侧的K+-H+-ATP酶。它与阳离子-ATP酶在活性位置的结合是可逆的。酶-阳离子-钒酸盐复合物比酶-阳离子-磷酸酸盐复合物稳定,因此阻断被ATP磷酸化,又阻断作为泵活力的部分阳离子(Na+、K+)后来的水解和释放。钒酸盐在体内可抑制50%Na+-K+-ATP酶活力,因此钒可能有调节体内细胞代谢的功能。
(3)钠-钾-ATP酶的控制在正常情况下,钠-钾-ATP酶的细胞外K+结合位置近乎饱和,而饱和Na+结合位置只半饱和,所以细胞内钠对酶的控制比细胞外钾理更重要。当Na+含量为5.8mM时,细胞内外离子浓度的变化可以调节泵活力。每个细胞酶单位数的变化也改变泵活力。糖皮质激素、甲状腺素、盐皮质激素、胰岛素和儿茶酚胺都能影响酶的活力,钒酸盐及内源毛地黄样物质抑制此泵。
(4)肾和肾外K+的分布和代谢 Na+-K+-ATP酶在体内调节钾分布中起主要作用。血管外间隙的容量主要由Na+决定,当Cl-和水随着Na+漏入细胞内时,若不能排除,就将破坏平衡,引起细胞内水肿,电化学梯度降低。
钾负荷后的钾平衡是肾和肾外组织的排钾和代谢之和。尿中钾的排出量大致膳食钾摄入量相等。摄入量在3至150~200mmol·d-1,肾能适应,防止机体钾浓度的巨大变化。急性钾负荷的小狗,在4h排出负荷剂量40%,其余60%分布在细胞内,只有小部分保存在血浆和组织间液。当血浆钾在3.8~7.4mmol·L-1。范围,钾分泌增加。
在肾脏中钾的 排泄主要在远曲小管和收集管中,但钾的运输出现在整个肾单位(图6-6)。钾经肾小球过滤,以比较恒定的速[率,将滤出钾的50~70%,与钠和水偶联运输到近曲小管和享利髓襻重吸收,残留一小部分到达远曲小管上皮细胞,与H=竞争与滤淮中的Na+交换,由收集管和乳头管排泄。后者为排钾的显要位置。排入小管的净钾量增加,它是①醛固酮浓度、②钠含量、钠及其伴随阴离子的释放速度、③细胞内K+和H+离浓度的函数。
醛固酮及其它盐皮质激素促进远曲小管、收集管及一些其他上皮组织如肠粘膜、唾液腺中钠的重吸收和钾分泌。尿中Na+/K+比值常用作盐皮质激素效用的指标。
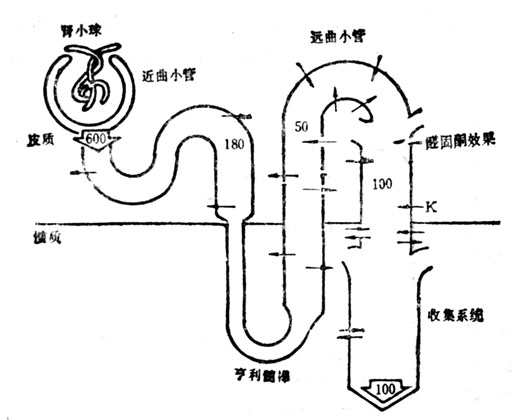
图6-6 整个肾单位中钾浓度和钾运输的图解、数字为腔内K浓度,箭头表示运输方向
在肾单位中醛固酮的作用位置,主要在Na+、K+和Cl-运输出现主要变化的皮质收集管内,很少在远曲小管。H=排出受髓质收集管中醛固酮的调节。排H+多时间钾少,反之,排K+较多时排出H+少。这过程与小管中尿的酸化有关。
当远曲小管中钠浓度增加并存在不能透过的阴离子时,腔内负电荷增加而增强钾流入小管液中。许多利尿剂能使大量液体运到远曲小管,容量的改变,经过肾素-血管紧张肽系统改变醛固酮而增加钾的排出。
酸中毒和碱中毒时细胞内钾浓度、激素及腔液内有关离子的改变可影响钾的排泄。代谢性碱中毒、急性短期低碳酸血症、镁缺乏时,肾排钾增加,负钾平衡。管腔中PH降低、NH+4排出多、急性代谢性酸中毒和短期高碳酸血症时降低钾的排泌。
(5)肾外钾的内环境稳定正常情况下急性钾负荷剂量的一小半由肾排出,一大半由肾外机制处理来防止潜在的致死性血钾过高。肌肉和肝脏是钾储藏最多的组织,提供另一条排钾途径。一些激素主动调节,其中醛固酮和胰岛素最重要。
①盐皮质激素:钾负荷后1.5h醛固酮就强烈影响肾钾排出。这对适应长期过量钾吸收很必要。盐皮质激素影响粪,也影响唾液腺中Na+和K+的排量。胃肠道中钾交换最重要的位置在结肠,积累性的电解排泄变化不大但有意义。
醛固酮能大大改变汗腺中的钠运输,这对习服湿热环境很重要。因为利用结肠排钾,汗钾未见增加,但汗钾的连续丢失,结果使体钾下降。
关于盐皮质激素对肌肉和肝脏中K质吸收的影响仍有争论。肾和肾上腺切除的动物预先给醛固酮或氧皮质酮(DOC)能比未用药者有较大的抵抗急性钾负荷的能力。这说明肾外组织的钾吸收由肾上腺调节。当肾上腺切除的动物服盐皮质激素后,组织钾含量明显降低。螺旋内酯(阻断盐皮质激素的钠尿和钾尿活动)可逆转此作用,但核黄素类似物(仅阻断盐皮质激素的钠尿活动)不能逆转此作用。
②糖皮质激素:服糖皮质激素后,肾脏清除的钾急剧增加,GFR和钠排出也同时增加。但这个作用是暂时的。因为氢化可的松有一些内在的盐皮质激素活性和某些皮质激素受体对糖皮质激至少有亲和力。钾的内环境稳定和内源产生的糖皮质激素相互作用与剂量有关。正常人服糖皮质激素后看到粪中钾增钠减,作用似乎在结肠,这种变化出现在钠-钾-ATP酶活力改变之前。可能是特异性的。因为若单用盐皮质激素代替,不能完全纠正肾上腺切除后的结肠运输异常。
③儿茶酚胺:肾上腺切除对肾外钾内环境稳定的另一个影响是肾上腺素水平降低。急性钾负荷的致死作用,部分是由于同时服肾上腺素能的活动剂而花光的。输入儿茶酚胺,血浆钾有双相反应,α-受体的调节在3~5min内使血钾升高,被α-阻断剂抑制。以后通过β-受体调节迅速下降,可被β-阻断剂逆转。β2受体调节此作用。服cAMP或磷酸二酯酶抑制剂可以模拟此作用,有些临床情况中也可见到。用慢性的β-阻断剂治疗高血压时,血清钾稍增加但有意义。运动时血钾明显升高,被β-阻断剂治疗高血压时,血清钾稍增加但有意义。运动时血钾明显升高,被β-阻断剂增大。
儿茶酚胺调节胰岛素分泌的变化对钾的内环境稳定也很重要。β-激动剂刺激而β-阻断剂和α-激动剂抑制胰岛素释放。这些作用的临床重要性尚未完全清楚。但有些糖尿病人在某些情况下出现高钾血症。
④胰岛素:胰岛素降低血钾水平,对身体处理K+的急剧变化非常重要。它似乎直接影响钠泵,引起膜的超极化,有利于K+内流进入细胞。血浆胰岛素在生理范围内的变化,可使肝和肌肉中的钾吸收增加。临床糖尿病人偶见高钾血症。钾对胰岛素分泌的影响可能直接作用,血钾为0.3~0.7mmol·L-1不见刺激作用,当>1.0mmol·L-1时刺激胰岛素分泌,而胰岛素的增加抑制醛固酮的分泌,血清钾的降低又调节此作用。
胰高血糖素起初增加血钾水平,由于肝释放K+离子,接着增加胰岛素释放,K+水平较长期地下降。生理水平的胰高血糖素并不改变肾脏的钾排泄。
(6)钾的适应身体对钾负荷的反应有几种生理方法。钾摄入量渐渐增加后,身体有能力处理,否则将因钾负荷而致死,身体的这种能力称为“钾适应”。钾适应是靠增加肾和肾外组织的处理能力而调节的。肾的反应需要盐皮质激素。血清钾增加一个时期后,使醛固酮的生产增加,依次加速尿中钾的排出,小管中Na+-K+-ATP酶活力水平增加。这是否与盐皮质激素的活力有关?还是由于钠泵的独立变化?尚不清楚。功能性肾单位数减少和循环盐皮质激素降低的慢性肾病患者,同样可出现钾适应。主要由于小管周围钾浓度增加,钠泵活力增加,并不是醛固酮刺激的。急性钾负荷的肾外处理似乎凭长期增加K+摄入量而增强。但是醛固酮、胰岛素、儿茶酚胺及一些尚未明白的因素有协同作用,产生一个更有效的处理高钾负荷的办法。
总之,钾的内环境稳定的摄入、排出、细胞功能及其对环境与激素反应的总和。肾外组织的适应性变化,可以防止血浆钾浓度的急剧增减,而慢性增加时,则需要肾和肾外组织的处理,以防止致命的并发症。肾脏是调节体液、钠和钾平衡的主要脏器,肾功能的好坏,对血清钾的稳定是主要的决定因素之一。肾功能不全少尿或无尿时钾潴留,出现高钾血症;伴多尿时钾丢失而引起钾缺乏。肾功能衰竭时,水盐代谢紊乱与酸碱失衡均可危及生命。
6.6.4 缺乏或过多
(1)钾缺乏与低钾血症 钾缺乏是指体内钾总量的减少。血清钾低于3.5 mmol·L-1时称为低钾血症。由于血液水含量和钾在细胞内外分布的变动,体钾和血钾的变化有时并不一致,如常见细胞内钾已明显降低,而血钾可正常、升高或降低。
①发生原因:包括有摄入不足(长期禁食或少食而静脉补液内少钾或无钾)及损失过多,如A经消化道(频繁呕吐、腹泻、胃肠引流、长期用缓泻剂或轻泻剂);B经肾(各种以肾小管功能障碍为主的肾脏疾病如慢性肾火、慢性缺氧、摄入钠过多、应用利尿剂等钾随尿丢失);C在肾上腺皮质机能亢进(包括醛固酮增多症和皮质醇增多症)时,内生的肾上腺皮质激素增多,或长期应用肾上腺皮质激素治疗都可促使钾的排泄增多;D经汗丢失(强度劳动、高温作业或重运动训练时,由于大量出汗而损失钙)。此外,在大量注射葡萄糖时,钾随葡萄糖和磷酸盐而进入细胞内成为糖原,尤其应用腺岛素时可促使血浆中钾过低。多数周期性麻痹发作时,由于细胞外液中钾转移入肌肉及肝细胞内而发病,也有血钾过低。烧伤愈合期蛋白质合成增加,每合成1g蛋白质能潴留0.45mmol钾。应用维生素B12治疗后,红细胞和血小板前体吸收钾,可出现血钾过低,但总体钾不减少。其他在应用青霉素、甘草、棉酚、庆大毒素(Gentaamicin)等,常能引起钾缺乏或低血钾。
②症状:动物缺钾时,食量减少,体重下降,负钾平衡,蛋白质代谢失常,血细胞钾含量低,心、肾和肌肉中钾丢失,心肌细胞坏死,肌维生断裂,钠泵活力低。肾近曲小管细胞出现空泡,管腔扩大,故肾浓缩功能减退,尿的酸化作用也影响。
缺钾大鼠在高温环境中对热应激的耐受力降低,运动能力和作功较对照组小一半,死亡率增1倍。
健康人控制钾的摄入,使体钾下降10%时,无主诉症状;下降19~21%时,出现软弱、畏寒、头晕、缺氧、口渴;急性缺钾达15~30%时,出现严重腹胀、肠麻痹。
钾缺乏和低钾血症的临床表现:轻度或急性中度缺乏无明显症状。体钾缺乏达10%以上时症状明显,失钾速率越快,症状越明显。钾缺乏使神经肌肉应激性降低,肌肉无力,包括:骨骼无力,重者软瘫;肋间肌、横隔肌无力,出现呼吸困难、缺氧、窒息;平滑肌无力致腹膨胀、肠梗阻和肠麻痹。缺钾使心肌应激性增高、心音低钝、心率快、心律失常。心电图的特征是ST段压低,T波低平,出现了U波,QT延长。心分律失常以异位搏动为主,少数患者有传导阻滞。当见到反复短阵多形室性心动过速和心室扑动颤动时,可出现收缩期心跳骤停。肾血流量减少,输尿管和膀胱功能不良,排尿困难以致少尿或无尿。消化功能紊乱,食欲不振、恶心、呕吐。神经系统出现烦躁不安,倦怠,深腱反射消失,头晕,淡漠;重者神志不清,水盐代谢及酸碱平衡紊乱(低钾性碱中毒、低钾性手足搐搦症),血管麻痹可发生休克。
③诊断:详细询问病史以明确是否存在钾缺乏,找出低钾原因、失钾途径、进而明确起病缓急,估计失钾量。掌握症状体征及测定血钾、PCO2、PH、心电图及尿钾。
④治疗:积极治疗原发病,尽量去除发病因素。对轻度缺钾病例,可以鼓励多进富含钾的饮食。慢性病例可以口服钾盐,常用氯化钾3~6g·d-1,分3次服,不能耐受者可改用枸橼酸钾。
严重缺钾因病不能口服者,用KCL3~5g加于5%葡萄糖1000~1500ml静脉内滴注。速率:成人不要超过30mmol·h-1,小儿不超过4 mmol·h-1。低血钾病人对洋地黄敏感,正常剂量也可引起中毒,应作心电监护。对于不伴失氯或同时有酸中毒者也可用谷氨酸钾静脉滴注,原有肝病者更为合宜,一般以31.5%溶液20ml加于500ml5%葡萄糖液内滴注。补钾用的任何钾剂应用葡萄糖液稀释后静脉滴注,以免血钾聚然过度升高,抑制心脏发生意外。
(2)钾过多与高钾血症钾过多系体内钾总量增多。血钾浓度高于5.5 mmol·L-1称为高钾血症。
①发生原因:包括有A摄入过多——静脉内输入钾盐可引起高血钾。当肾功能不良及少尿时,或输钾过多或过快时更易发生;B排出困难——肾功衰竭、肾上腺皮质功能减退、肾远曲小管代谢性酸中毒等可使肾排钾能力降低;C细胞内钾外移——在血型不合的输血(或输入保存较久的血)或其他原因引起的大量溶血、缺氧、酸中毒、严重组织创伤、挤压综合征、急性癌溶胞作用综合征等情况下,大量钾从细胞内释出,入细胞外液与血液;D细胞外液容积减少或血液浓缩,如失水、失血,尤其有休克者,血钾浓度增高;E其它因抗癌药(amsacrine)、血管紧张肽I转变酶抑制剂(captopril)的应用都能引起高钾血症。
②症状:神经肌肉表现——症初起时患者全身软弱无力,躯干和四肢感觉异常,面色苍白,肌肉酸痛,肢体寒冷,动作迟钝,嗜睡,神志模糊,肌张力减低,肌腱反射消失,进而弛缓性瘫痪,呼吸肌麻痹,窒息;心血管表现——心电静息电位降低,房室传阻滞,心音减低,心率缓慢,缺氧,心律失常,严重时心室颤动,最后心脏停搏于舒张期。心电图特征是T波尖耸、QRS复合波增宽、P波降低或消失。酸碱紊乱。
③治疗:迅速采取降低血浆钾浓度的紧急措施,以防心脏损害。如应用钠盐以纠正酸中毒,稀释细胞外液,使钾移到细胞内降低血浆钾浓度。静脉给NaHCO344mmol加于200ml15%葡萄糖溶液作为试验剂量,用心电图监护。也可用3%NaCl3ml·kg-1或生理盐水10ml·kg-1或1M乳酸钠静脉注射液开始时用5~7ml·kg-1,以后酌情调整。或采用葡萄糖0.5g·kg-1和胰岛素0.1u·kg-1,使钾用于糖原合成,而由细胞外移入细胞内。或使用钙剂以拮抗钾的作用,静脉注射葡萄糖钙0.25mmol·kg-1。其它应用离子交换树脂,人工肾、腹膜透析和结肠透析等疗法。与以上急救的同时,重视去除高钾原因,停用含钾食物和药物,严禁摄入钾盐,加强钠钾ATP酶的功能。
参考文献
1.Felix Bronner;akW,Cobourn (Editors),Disorders of mineral metabolism vol.2 Calcium physiology Academic Press,New York,1981
2.Idem.,ibid.,vol 3Pathophyssiology of Calcium,Phosphorus and Mangesium,Academic Press,New York,1981
3.Editorial:Nutr.Rev.40(7)216,1982
4.Lindsay H Allen:Am.J.Clin,.Nutr.35(4)787,1982
5.Zemel M B and Linkswiler H M:J.Nutr,111(2)315 ~ 324,1981
6.Robert P H et a;:Am.J.Clin.Nutri.Suppj.36:L986,1982
7.Spencer H et al:Am.J.Clin.Nutr.36(1)32~40,1982
8.中国生理科学会第三屈全国营养学术会议文摘要汇编1981
9.Turner S T et al:Am.J.Physiol.243(5)C227~236,1982
10.Warren,E.C.Wacker,Mangnessium in Man.Harvard Univ.Press,Cambridge,Massachusetts and London,England,1980
11.Turlapaty P D M V and Altrra B M:Science,208:198 ~200,1980
12.Solmon,Papper(Edd),Sodium:its biological significance,CRC Press,1982
13.张光金等:上海医学6(9)497~500,1983
14.Ljungman S:Actaa,Med.Scand.Suppl 663:1 ~ 67,1982
15.Manning E C and Machen T E:Am.J.Physiol.238:G403,1980
16.吴正宙等:肺心病低氯血症100例分析,江西医学1982增刊78~79
17.Robert,Whang,Potassium:its biological significance,CRC Press,1983
18.Stanton B A and Giebisch G.H:Am.J.Physiol.243(5)F487 ~ 493,1982