
第二十四章 DNA的克隆与序列测定
近20年来分子克隆技术的发展突飞猛进,重组DNA操作技术包括的范围不断扩大,DNA克隆的方法亦多种多样,特别是PCR技术的应用,以及RFLP、SSCP等技术的开展,使得DNA克隆技术的应用日益广泛。
DNA克隆技术在动脉粥样硬化等疾病的病因及诊疗研究中也有重要的作用。例如在研究脂蛋白酯酶基因发生的特异突变时,可以设计合成扩增引物,进行模板DNA的PCR扩增,所得的PCR产物较小,仅有300多bp,且纯度不足以进测序。为了对此突变序列进行测序分析,就可以采用DNA克隆的方法,将此PCR产物连接到细菌质粒上,再进一步纯化后测序,以便鉴定脂蛋白酯酶的突变序列。
下面简要介绍DNA克隆和测序的常用方法。
第一节 DNA的克隆
以质粒或噬菌体作载体进行DNA克隆,在理论上是很简捷的,即用一种限制酶切割质粒DNA,然后在体外与外源,DNA(如干扰素基因,生长激素基因)相连接,再用所得到的重组质粒转化细菌如大肠杆菌,以鉴定重组DNA。
通常所用的质粒载体有pBR322、pUC18、pUC19等,噬菌载体有M13噬菌体载体等。

图24-1 质粒载体的定向克隆
一、质粒或噬菌体载体与外源DNA的连接反应
外源DNA片段末端的性质,以及质粒载体和外源DNA上限制酶切位点的性质决定了质粒或噬菌体与外源DNA连接反应的不同策略。
(一)外源DNA带有非互补突出端的片段
用两种不同的限制酶分别消化质粒等载体和外源DNA,可以产生带非互补突出端的片段,这是最容易连接的片段,如图24-1所示。
将已经连接外源DNA的细菌质粒载体转化感受态的大肠杆菌,然后在含有AP等抗生素的平板上鉴定阳性重组体菌落,具体方法有:①检查α互补能力的丧失情况;②对小量制备的质粒DNA进行限制酶切的分析;③核酸杂交。
(二)外源DNA带有相同末端(平端或粘端)的片段
带有相同末端(平端或粘端)的外源DNA片段必须克隆到具有匹配末端的线状质粒或噬菌体载体中,在连接反应中,质粒或噬菌体载体可能发生自身环化,也可能形成串联寡聚物。因而,常常使用碱性磷酸酶去除5’磷酸基团以抑制质粒DNA的自身连接和环化。用细菌碱性磷酸酶(BAP)或牛小肠碱性磷酸酶(CIP)去除线状DNA两端的5’磷酸可以最大限度地减少质粒DNA的自身环化。而具有5’末端磷酸的外源DNA片段可有效地与去磷酸化质粒DNA相连接,产生一个含有两个切口的开环分子。因为环化DNA(即使只带切口的环状DNA)的转化效率比线状DNA高得多,所以大多数转化体都含有重组质粒,如图24-2所示。
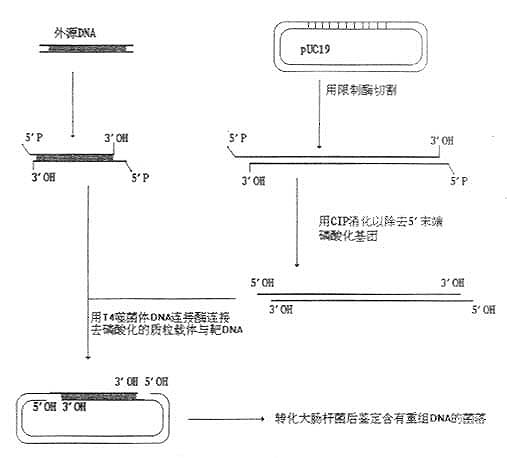
图24-2 利用磷酸酶防止载体DNA的重新环化
(三)外源DNA带有平端的片段
外源DNA片段带有平端的片段,平端的连接效率比带有互补末端的DNA要低得多。因此,涉及平端分子的连接反应所要求的T4噬菌体DNA连接酶的浓度和外源及质粒DNA或噬菌体DNA的浓度都要高得多。
(四)连接反应的体系
10×连接缓冲液1μl
10mM ATp 1μl
质粒或噬菌体DNa 200ng~1μg
外源DNa 200ng~1μg
T4噬菌DNA连接酶0.5~2nuits
4-6℃温育8~24h
连接反应结束时,取1~5μl上述反应混合物转化200μl的大肠杆菌感受态细胞,即可将外源DNA与载体接连起来。
二、大肠杆菌感受态细胞的制备和转化
细菌转化的方法多以Mendel和Higa(1970)的发现为基础,其基本方法是用冰预冷的CaCl2或多种2价阳离子等处理细菌,使之进入感受态得以转化。
用CaCl2制备新鲜或冷冻的大肠杆菌感受态细胞,常用于成批制备感受态细菌。本法适用于大多数大肠杆菌菌株,且迅速、重复性好。操作过程简述如下。
1.从37℃培养16~20h的新鲜平板中挑取一个单菌落(如大肠杆菌DH52),或1ml新鲜的16~20h过夜培养物,转到一个含有100mlLB培养基的1L或500ml烧瓶中。于37℃剧烈振摇培养约2~3h(旋转摇床200~300r/min),每隔20~30min测量OD600值≈0.4。
2.在无菌条件下将细菌转移到一个,用冰预冷的50ml聚丙烯离心管中,在冰上放置10~20min。
3.于4℃用SorvallGS2转头(或与其离心管相配的转头)以4000r/min离心10min,以回收细胞。
4.倒数培养液,将管倒置1min以使最后残留的痕量培养液流尽。
5.以10ml用冰预冷的0.1mMCaCl2重悬每份沉淀,放于冰上。
6.于4℃用SorvallGS3转头(或与其相应的转头)以4000r/min离心10min,以回收细胞。
7.倒出培养液,将管倒置1min以使最后残留的痕量培养液流尽。
8.每50ml初始培养物用2ml冰预冷的0.1M CaCl2重悬每份沉定,此时,可以迅速将细胞分装成小份,液氮中冰冻,-70℃贮存备用。
9.用冷却的无菌吸头从每种感受态细胞悬液中各取200μl转移到无菌的微量离心管中,每管加DNA或连接反应混合物(体积≤10μl,DNA≤50ng),轻轻旋转以混匀内容物,在冰中放置30min。
10.将离心管放到预加温到40℃的循环水浴中的试管架上,放置90s~2min,不要摇动试管。
11.快速将管转移到冰浴中,使细胞冷却1~2min。
12.每离心管加800μlSOC培养基,用水浴将培养基加温到37℃,然后将管转移到37℃摇床上,温育45min使细菌复苏,并且表达质粒编码的抗生素抗性标记基因。
13.将适当体积(每个90mm平板可达200μl)已转化的感受态细胞转移到含200mmol/l MgSO4和相应抗生素的SOB培养基上。
14.将平板置于室温至液体被吸收。
15.倒置平皿,于37℃培养,12~16h后可出现菌落。
三、用M13噬菌体转染感受态细胞
1.感受态细胞的制备
(1)用JM101或TG1等菌的培养菌液在M9基本培养基平板上的划线培养,于37℃温育24~36h。
(2)批量制备冻存的感受态细胞的方法,同大肠杆菌感受态细胞的制备。
2.用M13噬菌体转染感受态细胞
(1)用2×YT或SOB培养液于37℃持续地振摇,将用于铺平板的细胞(JM101或TG1等)培养过夜。
(2)从-70℃以下冰箱中取出一份冻存的JM101或TGI感受态细菌,于室温慢慢融化,立即放在冰上10min。
(3)于各感受态细胞管中,加入连接反应液,应同时做两个对照,一个加5pgM13噬菌体双链环状DNA,另一个则完全没有DNA。轻弹管外壁使其混匀,冰浴30min。
(4)取数支无菌培养管,分别加入3ml熔化的2×YT或SOB顶层琼脂,置47℃以备步骤6使用。
(5)将装有感受态细胞和DNA的培养管放入42℃水浴,温育整整90s,立即将管放回冰浴之中,2min后各管加入1ml过夜培养的JM101或TG1等菌液,混匀。
(6)在步骤(4)准备的装有溶化的2×YT或SOB顶层琼脂的管内各加入40μlX-gal溶液(20mg/ml,溶于二甲基甲酰胺)和4μlIPTG溶液(200mg/ml)振荡混匀,分别取(5)中混合物各300μl加入各管,振荡混匀,立即将管内混合物倾入标记好的LB琼脂平板上,轻轻旋动平皿,以使细菌与顶层琼脂分布均匀。
(7)盖好平皿,于室温放置5min,使顶层琼脂凝固,将平板倒置于37℃培养。4个h后噬斑开始出现,8~12h后菌斑不再变化。野生型M13噬菌体形成的噬斑为深蓝色,重组噬菌体则可形成无色噬斑。
四、含重组质粒的细胞菌落的鉴定
含重组质粒的细胞菌落常用的鉴定方法有:①小规模制备质粒DNA进行限制酶切分析;②α互补;③插入失活;④杂交筛选。下面简要介绍小规模制备质粒DNA进行限制性酶切分析。小规模制备质粒DNA可用天美等公司的Wizard Minipreps DNA试剂盒或采用下述方法:
1.挑取一些独立的转化菌落进行小规模培养,用无菌牙签或挑种环挑取单菌落于2ml含有相应抗生素的LB液体培养基中,于37℃剧烈振摇下培养过夜。
2.将1.5ml培养物倒入微量离心管中,用微量离心机于4℃以12000g离心30s,将剩余的培养物贮存于4℃。
3.吸取培养液,使细菌沉淀尽可能干燥。
4.将细菌沉淀重悬于200μl溶液Ⅰ中,剧烈振荡。
溶液Ⅰ 25mmol/L Tris·HCl(pH8.0)
10mmol/L EDTA(pH8.0)
溶液Ⅰ可成批配制,每瓶约100ml,高压下101bf/m2(6.895×104pa)蒸气灭菌15min,贮存于4℃。
5.加200μl新配制的溶液Ⅱ。
溶液Ⅱ 0.2mol/L NaOH
1% SDS
盖紧管口,快速颠倒离心管5次,以混合内容物。应确保离心管的整个表面均与溶液Ⅱ接触。不要振荡,将离心管放置于冰上。
6.加200μl溶液Ⅲ
溶液Ⅲ 5mol/l 乙酸甲 60ml
冰乙酸11.5ml
水28.5ml
盖紧管口,将管倒置,温和振荡10min,使溶液Ⅲ在粘稠的细菌裂解物中分散均匀,之后将管置于冰上3~5min。
7.用微量离心管于4℃以12000g离心5min,将上清转移另一离心管中。
8.加等量酚和氯仿,振荡混匀,用微量离心机于4℃以12000g离心2min,将上清转移到另一离心管中。
9.用2倍体积的乙醇于室温沉淀双链DNA,振荡混合,于室温放置2min。
10.用微量离心机于4℃以12000g离心5min。
11.小心吸去上清液,将离管倒置于一张纸巾上,以使所有液体流出。再将附于管壁的液滴除尽。
12.用1ml70%乙醇于4℃洗涤双链DNA沉淀,按步骤1所述方法去掉上清,在空气中使核酸沉淀,干燥10min。
13.用50μl含无DNA酶的胰RNA酶(20μl/ml)的TE重新溶解核酸,振荡,贮存于-20℃。
14.用适当限制性内切酶分析所得DNA。
五、M13噬菌体重组DNA分子导入大肠杆菌
1.感受态细胞的制备
(1)将1ml过夜培养的细菌(如DH52、TG1、TM101)接种于100ml2×YT培养于500ml烧瓶。于37℃刷烈振荡,通常≥200rpm培养的细菌密度约OD550=0.2~0.5(5×107cells/ml),需2~4h。
(2)将培养物放于冰上致冷10min,于4℃离心细菌培养物,10000rpm离心10min。
(3)弃除上清,将细菌悬浮于原始培养体积的一半(约50ml)的50mMCaCl2和10mm Tris·HCl(pH8.0)无菌冷冻液体中。
(4)将细菌悬浮放在冰上约5min,然后将悬浮物于4℃10000/rpm离心10min。
(5)弃上清,悬浮细菌于原始培养体积的1/15的50mMCaCl和10mMTris·HCl(pH8.0)无菌冷冻中。此时的细胞是感受态细胞,即可用于转化。200μl分装于无菌的1.5ml微量离心管中,贮存于-80℃冰箱中。
2.转化程序
(1)取出200μl感受态细胞慢慢使其溶化,并立即放于冰上,加入DNA或连接反应混合物,DNA量通常≤50mg。用手指弹打试管10次,使之混匀,然后放在冰上40~45min。
(2)将管放于42℃水浴中2min。
(3)然后每管直接加入1.0ml2×YT培养基,倒置混匀,并于37℃培养8~12h,干浴或水浴,不需振摇。此期间使细菌生长并开始表达抗菌素。
(4)每200μl转化混合物分别于6个2×YT琼脂培养板上补充相应抗生素,并含有X-gal(20mg/ml)、IPTG(200mg/ml)。
(5)铺板使细菌混合物干后,倒转平板放于30~37℃培养箱中18~22h。克隆在此期间应该出现,否则转化不成功。