第二十章 低密度脂蛋白受体的检测
脂蛋白受体主要包括乳糜粒受体(CM-R)、极低密度脂蛋白受体(VLDL-R)、低密度脂蛋白受体(LDL-R)、高密度脂蛋白受体(HDL-R)和清道夫受体(scavenger receptor)等。脂蛋白受体的检测与一般受体检测方法的原理及操作基本类同。目前研究最多,应用最广的要属LDL-R,其他脂蛋白受体如清道夫受体、VLDL-R等的检测方法与LDL-R基本相似,多采用125Ⅰ标记的配体检测或是3HTdR掺入法等。本章以LDL-R为代表介绍脂蛋白的检测方法。
低密度脂蛋白受体(LDL-R)广泛分布于人与动物的各种细胞和组织,如肝细胞,成纤维细胞,血管平滑肌细胞,淋巴细胞,单核细胞及肾上腺、卵巢等。LDL-R是一种跨膜糖蛋白,位于细胞表面被膜凹的浆膜部位。主要功能是参与LDL-R的代谢过程,与含有ApoB100、ApoE的LDL、β-VLDL等结合,并内吞入细胞,LDL-R缺乏则导致血中胆固醇异常。家族性高胆固醇血症(FH)是LDL-R基因突变引起的LDL-R缺乏以致胆固醇异常的显性遗传性疾病。其特征为血胆固醇显著升高、黄色瘤和早发心肌梗塞。人群中杂合子型FH(LDL-R减少)发生频率为1/500,纯合子型FH(LDL-R缺乏)较少见,发生频率约为1/1000000,通常在儿童期即发生心肌梗塞。FH的发病率在我国也是比较高的,因此LDL-R的检测对于筛选人群中的FH患者及预防冠心病、心肌梗塞等具有重要意义。
细胞表面的LDL-R的分析可通过以下几种检测方法进行:检测同位素或非同位素标记的LDL与LDL-R的结合力(或率),推算受体最大结合浓度,在限制性生长条件下检测细胞分裂抑制率。判断LDL受体活性;用抗体直接测定LDL-R量或者对受体直接进行蛋白质结构和基因图谱分析。
第一节 受体与标记配体的结合分析
为了体外研究脂蛋白的细胞代谢和脂蛋白受体活性,早在1974年Goldstein和Brown就建立了成纤维细胞125I标记LDL的配体-受体结合分析法。其基本原理是:用放射性同位素(常用125I)标记LDL后,与细胞(通常为培养的单层成纤维细胞)、组织或含有LDL-R的制剂一起孵育,使LDL-R与125I-LDL充分结合,形成受体-配体复合物,再除去未结合的125I-LDL,测定结合沉淀物中的放射性。同时检测细胞、组织或受体制剂的蛋白质含量,即可计算出与125I-LDL结合的LDL-R量。本法由于使用同位素,采样困难和操作过程繁琐,且费时、昂贵,故在临床诊断上难以广泛开展。
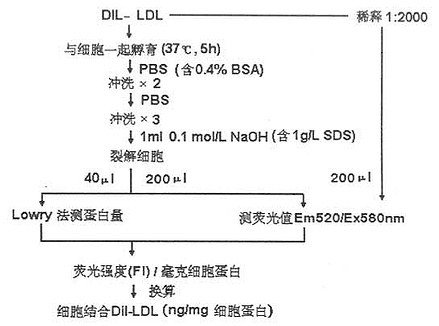
Teupser等于1996年建立了直接荧光法检测LDL-R,他们采用1,1’二(十八烷基)-3,3',3',3'-四甲基吲哚羰基花青高氯酸盐(1,1'-dioctadecy1-3,3,3',3'-tetramethylindocarbocyanine perchlorate,DiI)标记LDL,原理与同位素标记LDL相同。其操作步骤见图20-1。直接荧光法可定量检测附着的或非附着的各种类型的培养细胞(如正常人或FH病人的皮肤成纤维细胞、淋巴细胞、人U-937和鼠P388D1巨噬细胞系)的LDL-R和清道夫受体,其特点是特异性强,灵敏度高,不使用有机溶剂、不需预先进行脂质抽提,并省去了多步抽提步骤。正常人平均最大结合浓度为10.3±1.1μg/mg细胞蛋白,FH杂合子为5.2±0.8μg/mg细胞蛋白,FH纯合子0.9±0.2μg/mg细胞蛋白。

图20-1 直接荧光法测LDL-R操作步骤
亦有用胶体金标记LDL的,但是在受体-配体结合分析法中,正常人与FH患者的测定值有较明显的交叉现象,且操作比较繁琐。
1987年Roach等比较了在硝化纤维素上用125I-LDL、生物素-LDL、生物素-LDL、胶体金-LDL和胶体金-LDL结合银染四种方法检测LDL-R,发现胶体金-LDL结合银染的方法最为敏感,且安全、简单、快速、便宜。比较结果见表20-1。
表20-1 硝化纤维上检测LDL-R的几种方法比较
| 因素 | 125I-LDL | 生物素-LDL | 胶体金-LDL | 胶体金-LDL加银染 |
| 时间 | 12~24h | 3h | 5~10min | 20min |
| 敏感性 | 1.6fmoles | 1.6fmoles | 1.6fmoles | 193amoles |
| 线性范围 | 0.5~15μg | 0.5~4μg | 0.5~4μg | 0.06~2μg |