第二节 血管平滑肌细胞的形态及性质
在动脉粥样硬化形成过程中,首先表现为脂质沉积于血管壁,然后巨噬细胞吞噬这些脂质,逐渐泡沫化,继而平滑肌细胞增殖生长。平滑肌细胞形态、生理生化的变化是与动脉粥样硬化有关的又一重要因素。
一、血管平滑肌细胞的形态与性质
血管平滑肌细胞在增殖状态下,主要表现为细胞胞浆内蛋白质的变化。例如,胎儿期及培养细胞的增殖期平滑肌细胞含有广泛丰富的肌丝,表现为蛋白质合成和胞外基质分泌旺盛,这时称之为合成型细胞。反之,成人机体动脉中膜平滑肌细胞称为收缩型细胞。
随着细胞形态的改变,肌丝不仅在量上发生变化,组成肌丝结构的蛋白质种类也发生变化,已知平滑肌肌动蛋白含有三种不同等电点的α、β、γ同型异构体。合成型细胞蛋白的组成为β、γ,收缩型则是以α为主,在平滑肌细胞分化增殖过程中分子量发生改变。肌球蛋白的重链也存在异构体,目前已发现分化成熟的平滑肌细胞肌球蛋白具有SM1和SM2两种异构体,在胎儿期,除含有SM1外,还有其他型肌球蛋白。平滑肌肌球蛋白重链(SMemb)含有多种异构体,已被作为形态,性质改变的指标。
二、平滑肌肌球蛋白重链异构体在分化中的改变
兔大动脉内平滑肌肌球蛋白SM1从胎儿期到成年是一致的。而SM2则在新生儿后才出现。另外,有一种胎儿型平滑肌肌球蛋白在胎儿新生儿出现较多,年龄增长则逐渐减少。肌球蛋白量和质的变化是平滑肌细胞在分化过程中的主要变化。
在胎儿期肺动脉与主动脉相连,肺循环与体循环间相连的动脉导管的平滑肌显示特异的细胞性质,这一导管在婴儿出生后会自动关闭,虽然机制不明,但与平滑肌细胞肌球蛋白组成和性质改变有关。例如SM2不存在于出生前的其他血管中,但却在动脉导管内存在,提示SM2的变化是平滑肌细胞在分化中改变最明显的一个特征。
三、球囊导管损害模型与内膜平滑肌的改变
利用球囊导管制作的动物模型,平滑肌表现为类似胎儿期平滑肌特征。免疫学方法测定显示抗SM1和抗SMemb阳性,抗SM2阴性,说明球囊导管损伤血管后,平滑肌细胞内SM2消失,平滑肌细胞由收缩型转变为合成型。电子显微镜下,血管损伤后的平滑肌细胞与胎儿平滑肌细胞极其相似。
四、人动脉硬化病变的基础
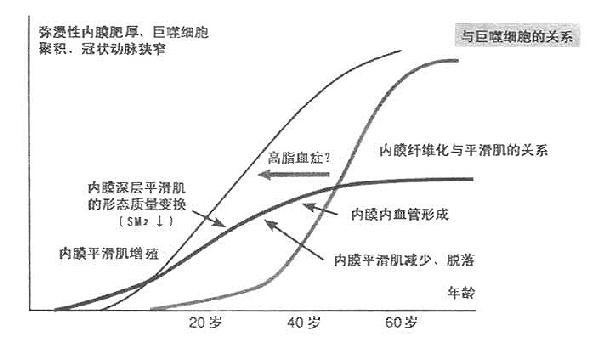
人类动脉硬化的发生与发展是经历数年或数十年的过程,开始表现为平滑肌的增殖和变性,然后泡沫化的巨噬细胞加速病变。人类动脉硬化有其自身特点,在10岁左右内膜平滑肌即开始增殖使内膜肥厚,但这种弥漫性肥厚(dittuse intimal thicking,TID)不同于浸润性的动脉粥样化硬化式的肥厚,弥漫性动脉内膜肥厚的动脉粥样硬化发生率也高。因此,弥漫性动脉内膜肥厚被认为是发生动脉粥样硬化的基础之一。
平滑肌肌球蛋白肌丝的抗体,对不同年龄人的冠状动脉的免疫组织学检测显示胎儿冠状动脉内膜阴性,而中膜阳性,说明肌球蛋白仅仅存在于中膜。胎儿早期(20周前)SM2阴性。10岁左右内膜已经形成较厚的平滑肌层。这种内膜平滑肌SM1、SM2、SMemb抗体测定均为阳性,与中膜平滑肌没有区别。这种内膜平滑肌的增殖在开始时形成同心圆,到20~30岁时渐渐改变为偏心状,此时,内膜和中膜间质发生缓慢的增殖,但尚不存在增殖细胞,也不见增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)阳性细胞及巨噬细胞,到40岁时,在接近中膜的内膜深部发生平滑肌细胞形态的变化,这种变化表现为SM1、SM2、以及α-肌动蛋白的消失。虽不明确原因,但肯定与巨噬细胞无关。平滑肌细胞数开始逐渐减少,而纤维化增加。在50~60岁时,内膜平滑肌细胞常常脱落,内膜纤维化显著增加。在纤维化的内膜层可见巨噬细胞的集积,但为数不多,这与冠状动脉硬化狭窄有显著不同,所以仍被看作是从青少年期开始弥漫性内膜肥厚的继续。
五、主动脉粥样硬化病变
主动脉粥样硬化病变表现为泡沫化的巨噬细胞大量集积,主动脉内膜肥厚,但组成内膜的细胞主要是巨噬细胞,泡沫细胞以及SM2消失的平滑肌细胞。这一个病理变化过程如图所示11-2所示。

图11-2 内膜平滑肌增殖和巨噬细胞集积对冠状动脉的影响
综上所述,平滑肌细胞是参人动脉粥样硬化的主要细胞之一,其自身的变化特征是SM1、SM2的变化。