第十一章 动脉粥样硬化有关细胞及生物活性因子
随着血管细胞研究的深入,血管细胞的许多功能不断被揭示和认识。近年来,由于动脉粥样硬化诱发的心肌梗塞、脑梗塞等疾病的增加,引起人们对动脉硬化发生、发展机制给予更深切地关注。经许多实验证明,这一疾病发展过程与血管细胞功能异常密切相关。
第一节 血管内皮细胞的功能
在病理学上,动脉粥样硬化以动脉内膜脂质沉着和平滑肌细胞从中膜移行至内膜扩张性增殖引起的内膜肥厚和狭窄为血管病变的主要特征。病变初期,在内膜表现为轻度的细胞性、纤维性肥厚,继而出现脂肪性和纤维性肥厚层,最后形成粥样斑块病变。
至今,有关动脉粥样硬化机制有多种学说,一般认为是血管内皮细胞机能的变化和损害引起内皮细胞的剥离,血浆成分(脂质)的浸润,巨噬细胞的浸润,内膜内平滑肌细胞增殖,在这一系列反应过程中,血管内皮细胞的损害和机能异常发生最早,对动脉硬化的发生、发展极为重要。本节以血管内皮细胞的功能为重点,阐述血管内皮细胞在动脉粥样硬化发生、形成、修复过程中的作用。
一、血管内皮细胞的功能
血管内皮细胞是连续被覆在全身血管内膜的一层细胞群,这一细胞群被体外细胞培养成功以来,对它已有了很深入的了解。现在认为内皮层不仅仅是血液和组织的屏障,还具有其他多种功能,如①减少血管通透性,调节组织与血液的物质交换,防止血浆成分和血液细胞无序地侵入;②抗血栓作用,平衡抗血液凝固纤溶系统和抗血小板机能,维持血液的流动性;③调节血管平滑肌功能,合成和分泌调节血管平滑肌舒张和收缩的相关因子;④抑制血管壁细胞的游走和增殖。
二、血管通透性
动脉粥样硬化病灶,好发于动脉分枝处。从血流动力学上分析,这些部位是血流速度缓慢且易形成涡流的地方。在这里由于加在血管壁血流的物理压力被分为垂直方向和切线方向,以力学表示,前者是血压后者是切力。血压可以通过内皮下粘膜弹性组织感受和缓冲,一般来说,血压越高,血管通透性越高。切力对内皮细胞以及通透性的作用,虽已在研究但结果不明确。
动脉粥样硬化灶内脂质沉积于内膜,在新生的内皮组织更为显著。体内实验观察到血浆成份向内皮下浸润是在内皮细胞分裂间期介入的。为了解脂质如何通过内皮细胞,将内皮细胞与低密度脂蛋白共同培养,发现内皮细胞的ApoB、ApoE受体与内皮细胞转运低密度脂蛋白无关;相反在组胺和凝血酶剌激状态下,通透性明显增强,LDL大量入侵。可见一些生物因子(如组胺)、切力、新生内皮细胞与内皮细胞通透性都有一定关系。
三、抗血栓性
19世纪病理学家Virchow提出血栓形成的三大要素为血管壁损害、血流停滞及血液抗凝系统异常。内皮细胞在正常情况下发挥抗血栓形成作用,维持血液流动性,但在血管壁受损和细胞素存在等外部因素作用下,组织因子(tissue factor,TF)被激活,内皮细胞抗血栓能力减弱,血栓就容易在血管壁内形成。在某些病理情况下,如内毒素的释放,细胞素等的剌激,亦可活化组织因子,引发弥散性血管内凝血(disseminated intravasculal coagulation, DIC)。心肌梗塞,脑梗塞等疾病也是由于血管内皮的破损、脱落而引发血栓。这些情况都与血管内皮细胞抗血栓作用下降有关。
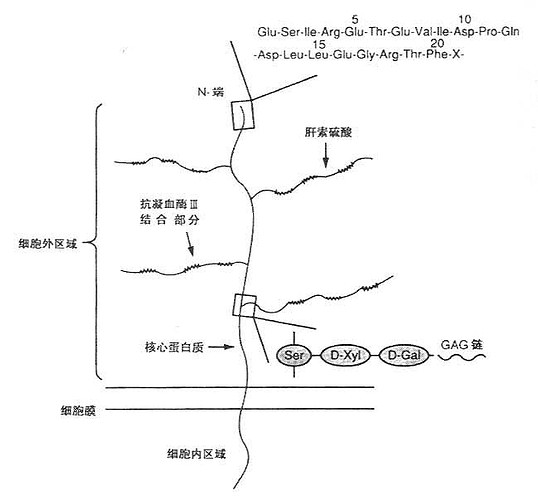
血管内皮细胞抗血栓作用的机制主要表现为:①合成和分泌抗凝因子,如分泌凝血调节蛋白(thrombomodulin)、肝素样物质和组织因子通路阻抑因子(tissue factor pathway inhibitor, TFPI);②合成和分泌促进纤溶因子,如组织纤溶蛋白激活因子(tissue plasminogen activator,t-PA);③合成和分泌抑制血管扩张和血小板凝集的因子,如分泌前列腺环素(prostacycline)。内皮细胞分泌的平滑肌松弛因子(endothelial-derived relaxing factor,EDRF)。这些因子共同作用,使血液保持流通状态,阻止血栓形成。这些因子的存在形式及结构如图11-1所示。
1.凝血调节蛋白
凝血调节蛋白是存在内皮细胞表面的一种糖蛋白,与凝血酶结合后能激活蛋白C,使其活性增强1~2万倍,蛋白C亦可被依赖性维生素K的凝血酶-凝血调节蛋白两者形成的复合物激活,蛋白C被激活后转变为活性蛋白C,具有阻断血液凝固系统的作用,与凝血酶-凝血调节蛋白复合物协同作用可使血凝系统中凝血因子以及血小板凝血活性丧失。

图11-1 血管内皮细胞表面抗凝性的肝素硫酸蛋白多聚糖结构
凝血调节蛋白在某些病理条件下,会在内皮细胞表面上的表达量下降。这也是血管炎症和感染时容易发生血栓的重要原因之一。此外,当血管内皮细胞受损破裂时,凝血调节蛋白被释放入血,血浆中含量升高,而其活性降低丧失,这一现象常见于系统性红斑狼疮(system lupus erythematosus,SLE)、DIC和糖尿病等。
2.肝素样物质
肝素样物质(硫酸类肝素)也存在于内皮细胞表面,是一类蛋白多聚糖,其中的糖链含有肝素样物质(heparin-like substance),多为硫酸肝素(heparin sulfate)。血液中抗凝因子-抗凝血酶一旦与肝素样物质结合,能使凝血酶及其活性凝血因子Ⅸα、Ⅻα、ⅩⅣα迅速失活(活性下降约1000倍),显示极强的抗血栓形成作用。
肝素样物质与凝血调节蛋白一样也能被IL-1和肿瘤坏死因子(TNF)等细胞因子所抑制。这种凝固与抗凝固平衡一旦被打破会导致全身血管内血液发生凝固或出血。动脉硬化后血管局部易形成血栓,这与内皮细胞抗血栓作用减弱密切相关。
3.组织因子通路阻抑因子
组织因子通路阻抑因子(tissue factor pathway inhibitor,TFPI),新生型的分子量为38kD,由一条肽链构成,又被称为脂蛋白相关凝血抑制因子(lipoprotein associated coagalation inhibitor,LACI)或外源通路抑制因子(extrinsic pathway inhibitor,EPI)。人的TFPI由血管内皮细胞合成,以结合方式存在于内皮细胞表面。TFPI与ⅤⅡa结合后阻止Xa与ⅤⅡa的结合,从而阻止外源性凝固系统的凝血激活反应。但血栓患者血中TFPI值异常的报告不多,这可能主要是由于TFPI不容易被测定。
4.纤溶系统的活化
纤溶系统的活化是由特异的血纤溶酶原激活物(PA),使血纤溶酶原转变为纤溶酶(plasmin),纤溶酶能降解纤维蛋白,纤维蛋白在纤溶酶作用下先从分子的Bβ链上裂解出一小肽,然后又在Aα链上裂解出碎片A、B、C和H,留下的片段为即X(M=240kD~260kD)后者再在纤溶酶作用下不断裂解,先后产生Y(M=150kD),D(M=100kD)及E(M=50kD)片段。它们统称为纤维蛋白原降解产物(FgDP)。这一过程可分别被体内存在的血纤溶酶原活性抑制物(plasminogen activation inhibitor,PAI)和α2纤溶酶抑制物(α2-plasmin inhititor,α2-PI)所抑制。
体内多种细胞能够产生组织纤溶酶原激活物(tissue plasminogen activator,tPA)。很早在尿中就发现纤维蛋白溶解活性物质(μPA)-尿激酶(urokinase,UK),UK可直接作用纤溶酶原使之活化为纤溶酶。当组织损伤时,尤其是内皮细胞受到血流切力、凝血酶等因素剌激会大量释放tPA,tPA与纤维蛋白有很高的亲和力,一旦结合,通过构型改变与纤溶酶原结合形成tPA-纤维蛋白-纤溶酶原三联体复合物激活纤溶酶原,纤溶酶原被激活后激发启动纤溶系统。
5.前列腺环素(prostacycline)
前列腺环素是内皮细胞、平滑肌细胞合成和分泌的生物活性物质,具有极强的破坏血小板凝集功能。其机制是拮抗血栓素A2(thromboxane A2,TXA2)的作用,从而抑制血小板的凝集。此外,前列腺环素促使cAMP(环腺苷酸)含量增加,抑制血小板的粘附能力,同时抑制平滑肌的增殖。这些作用都是抗动脉硬化的,当血管内皮受损时,前列腺素合成减少,会增加动脉硬化形成的可能性。
前列腺环素的生成量随高密度脂蛋白(HDL)、炎症介质(组胺等)的增加而增加,随低密度脂蛋白(LDL)、阿斯匹林等抗炎药物以及抽烟、老龄等因素增加而减少。
6.内皮细胞分泌的平滑肌松弛因子
内皮细胞分泌的平滑肌松弛因子(endothelial-devived relaxing factor.EDRF)由内皮细胞合成和分泌,它能促使cGMP(环鸟苷酸)水平升高,引起血管扩张,同时能抑制血小板聚集和对内皮细胞的附着。它与前列腺环素在体内相辅相成共同对血小板的活性发挥抑制作用。
四、血管活动性
血管壁持续痉挛收缩是高血压和急性缺血发生的重要原因。1980年Furchgott首次报告血管内皮细胞释放平滑肌松弛因子(EDRF)。除凝血酶等生物活性物质能剌激EDRF释放之外,血流切力等机械因素也能促使其释放。相反,高龄,高血压,动脉硬化,LDL等抑制其合成和释放。如前所述,EDRF具有抗血小板活性和抑制平滑肌增殖的作用,被认为与动脉硬化及其合并症以及高血压形成有关。另一方面,日本学者报告内皮细胞还能够分泌一种21个氨基酸短肽的平滑肌收缩因子(endothelial-derived constricting factor,EDCF),有关方面的研究已引起关注。
五、血管内皮细胞自身增殖和游走
动脉硬化时血管内皮细胞可被诱导对血管平滑肌的增殖发挥抑制作用,这一机制除了前述的由内皮细胞分泌的多种因子作用外,血管内皮细细胞自身在血小板、白细胞分泌的游走因子和血流切力剌激下也能增殖和游走。这一功能可能与动脉硬化灶的修复和新血管生成有关。