第七章 基因定位
基因组是生物的生殖细胞中所含全部基因的总和。人类基因组具有极其复杂的结构,其编码蛋白质的结构基因大约有100 000个,每个单倍体DNA含有3.2×109 bp,分布在24条常染色体和X,Y性染色体上。此外,还含有大量的非编码的重复DNA序列。基因定位(gene location)是用一定的方法将基因确定到染色体的实际位置。这是现代遗传学的重要研究内容之一。将不同的基因确定于染色体的具体位置之后,即可绘制出基因图(gene map)。
有两种基本方式制作人类染色体的基因图:即物理作图和遗传作图。物理作图(physical mapping)是从DNA分子水平制作基因图。它表示不同基因(包括遗传标记)在染色体上的实际距离,是以碱基对为衡量标准,所以物理图谱(physical map)最终是以精确的DNA碱基对顺序来表达,从而说明基因的DNA分子结构。从细胞遗传学水平,用染色体显带等技术在光学显微镜下观察,将基因定位不同染色体的具体区带,又称区域定位(regiona assignmer),而把基因只定位到某条染色体上称为染色体定位(chromosomal assignment)。这个水平上的基因图谱又称细胞遗传图(cytogenetical map)。分辨率可达5Mb至1Mb。遗传作图(genetic mapping)是以研究家族的减数分裂,以了解两个基因分离趋势为基础来绘制基因座位间的距离,它表明基因之间连锁关系和相对距离,并以重组率来计算和表示,以厘摩(cM)为单位。两个遗传座位间1%的重组率即为1厘摩。人类精细的遗传图水平可达1cM即100kb(1Mb)左右。
根据系谱分析和少数血型分析,就可确定某些基因位于X染色体上。X连锁关系确定后,再依重组率计算两者之间的相对距离,便可将两个基因定位于XX染体的相对位置上,1961年红绿色盲就是通过这种方法定位于X染色体上。
1968年Donahue依据系谱分析的原理,第一次将Duffy血型基因定位于第1号常染色体上。它在中期染色体时,发现1号染色体长臂1区的异染色质区有变异特征。继后,他发现在一些家族中,凡是具有这种形态特征的染色体都是Duffy血型者,从而将此血型的基因定位于第1号染色体上。伴随分子生物学和细胞分子遗传学的进展,基因定位的新方法不断出现,特别是体细胞杂交、分子杂交、DNA重组和DNA体外扩增(PCR)等技术后出现与应用,产生了许多定位新技术,如脉冲场凝胶电泳、染色体显微摄影、染色体步移和酵母人工染色体(YAC)克隆等,使基因定位的研究工作得到迅速发展。
自1973年第一次国际人类基因组制图(human genome mapping,HGM)会议召开以来,每隔2-3年就举行一次会议。在第一次HGM会议上,人类基因定位只有31个,而今迅速进展到已定位的基因4000多个,而且有一大批克隆基因和DNA遗传标记被定位,如表7-1所示。这些成果有力地推动了遗传咨询、基因诊断和基因治疗的进展,对医学理论和临床实践的发展起着十分重要的作用。
表7-1 HGM会议定位的克隆基因和DNA多态标记
HGM11(1999年) |
CCM(1992年) |
HGM12/CCM93(1993年) |
|
基因总数 克隆基因 多态标记 |
2778 1524 622 |
3301 713 |
4183 3808 850 |
DNA节段总数 多态标记 克隆DNA |
6974 2608 9760 |
12376 3250 16277 |
25640 5114 29833 |
多态标记总数 微卫星 |
3230 312 |
3963 812 |
5964 2427 |
第一节 基因定位的方法
基因定位可从家系分析、细胞、染色体和分子水平进行研究,同时由于使用手段的不同派生出多种方法,不同方法又可联合使用,互为补充。现仅就几个主要方法加以说明。
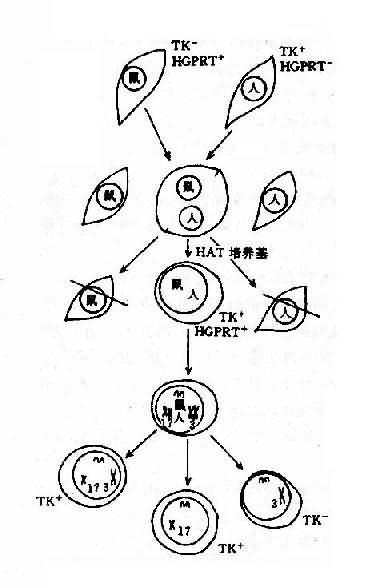
1.体细胞杂交法 体细胞是生物体除生殖细胞外的所有细胞。将从身体分离的体细胞做组织培养进行遗传学研究的学科称为体细胞遗传学(somatic genetics)。体外培养细胞可人为控制或改变环境条件,并可建立细胞株,长期保存,进行各种正常和病理研究。与基因定位有关的是体细胞杂交(somatic cell hybridization)。细胞杂交又称细胞融合(cell fusion),是将来源不同的两种细胞融合成一个新细胞。大多数体细胞杂交是用人的细胞与小鼠、大鼠或仓鼠的体细胞(hybrid cell)进行杂交。这种新产生的融合细胞称为杂种细胞(hybrid cell),含有双亲不同的染色体。杂种细胞有一个重要的特点是在其繁殖传代过程中出现保留啮齿类一方染色体而人类染色体则逐渐丢失,最后只剩一条或几条,其原因至今不明。这种仅保留少数甚至一条人染色体的杂种细胞正是进行基因连锁分析和基因定位的有用材料。由于人和鼠类细胞都有各自不同的生化和免疫学特征,Miller等运用体细胞杂交并结合杂种细胞的特征,证明杂种细胞的存活需要胸苷激酶(TK)。但凡含有人第17号染色体的杂种细胞都因有TK活性而存活,反之则死亡。从而推断TK基因定位于第17号染色体上(图7-1)。这是首例用细胞杂交法进行的基因定位。由此可见,研究基因定位时,由于有杂种细胞这一工具,只需要集中精力于某一条染色体上,就可找到某一基因座位。

7-1 体细胞杂交基因定位示意图
2.克隆嵌板法(clone panel method)是应用杂种细胞保留或丢失人染色体有时有重叠现象而设计的一种简便有用的基因定位方法。如表7-2所示,选择3个都保留有4条人染色体的杂种细胞克隆,但染色体各不相同。如果某一表型特征只出现于克隆A、C而不见于B,就可决定该特征的基因只能在3号染色体上,因为A、C克隆都有3号染色体,而B克隆则无,其它亦可同理判断这样3个克隆可对8条(23=8)染色体作出判断;如果是5个克隆(25=32)就可对人类22条常染色体和2条性染色体作出判断。例如半乳糖激酶(GK)、尿苷-磷酸激酶(UMPK)和氨基已糖苷酶A(HEXA)的基因就是用此法分别定位于人的17号、1号和15号染色体上的。此外,还可对杂种细胞进行特殊染色,来识别杂种细胞中人和鼠染色体,以助基因定位。
表7-2 克隆嵌板示意
杂种克隆 |
保留的人染色体 |
|||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
A |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
B |
+ |
+ |
- |
- |
+ |
+ |
- |
- |
C |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
在体细胞杂交基础上还发展了微细胞(micro cell)技术,即制备只含少数或一条人染色体的微细胞进行细胞杂交。也可将人中期染色体进行分离直接转移到鼠类细胞中,使人染色体在受体细胞中裂解变成短的DNA片段,并整合到受体细胞的基因组中。如两个基因同时整合进去,就证明它们的紧密连锁关系。
3.原位杂交和荧光原位杂交 重组DNA技术的建立与分子杂交相结合,从分子水平研究基因定位,发展了一系列有效方法。例如原位杂交(in situ hybridization)就是分子杂交技术在基因定位中的应用,也是一种直接进行基因定位的方法。分子杂交的基本原理是碱基的互补配对,同源的DNA-DNA双链或DNA-RNA链在一定条件下能结合成双链,用放射性或非放射性物质标记的DNA或RNA分子作为探针,可探测到细胞基因组中的同源部分。19770-1978年首次将分子杂交法应用于基因定位,即用α及β珠蛋白基因的cDNA为探针,与各种不同的人/鼠杂种细胞进行杂交,再对DNA杂交情况进行分析,找出cDNA探针与人染色DNA顺序间的同源互补关系,从而将人α及β珠蛋白基因分别定位于第16号和第11号染色体上。

图7-2 用原位杂交法将胰岛素基因定位于11p15
原位杂交的特点是杂交在显微镜载玻片上中期染色体标本上进行。所谓原位即指标本上DNA原位变性,在利用放射性或非放射性标记的已知核酸探针杂交后,通过放射自显影或非放射性检测体系来检测染色体上特异DNA或RNA顺序,可用放射性颗粒在某条染色体的区带出现的最高频率或荧光的强弱来确定探针的位置,从而进行准确的基因定位。图7-2表明用此法将胰岛素基因定位于11p15。但原位杂交必须在已知探针的情况下方可进行,而在未知致病基因时,则无法进行基因定位。
放射性同位素标记核酸探针与染色体显带结合进行原位杂交仍有不少缺点和局限性。例如需要使用放射性同位素的特殊实验室,自显影曝光时间长,同位素标记的探针不易保存,放射污染不利健康,特别是高质量的中期染色体标本在细胞培养基础上难以得到,观察费时,对间期核的研究难以进行等。
荧光原位杂交(florescence in-situ hybridization,FISH)是一种非放射性原位杂交方法。用特殊荧光素标记核酸(DNA)探针,可在染色体、细胞和组织切片标本上进行DNA杂交,对检测细胞内DNA或RNA的特定序列存在与否最为有效。探针不是放射性的而是将荧光染料与抗体蛋白结合进行检测。它们具有高度亲和力,有与放射性探针相同或更高的分辩率。现已可用不同的荧光染料同时进行多重原位杂交,显示出不同的荧光色泽。这种多色FISH技术近年来发展迅速,已成为基因定位作图和医学诊断的重要手段。1992年运用这种策略已能在中期染色体和间期细胞同时检测7个探针。科学家们的目标是实现24种不同颜色来观察22条常染色体和X、Y染色体。荧光原位杂交法提高了杂交分辩率,可达100-200kb。此法降低应用于基因定位外,还有多种用途,它已日益发展成为代替常规细胞遗传学的检测和诊断方法,在此不多论述。
4.连锁分析基因定位的连锁分析是根据基因在染色体上呈直线排列,不同基因相互连锁成连锁群的原理,即应用被定位的基因与同一染色体上另一基因或遗传标记相连锁的特点进行定位。生殖细胞在减数分裂时发生交换,一对同源染色体上存在着两个相邻的基因座位,距离较远,发生交换的机会较多,则出现基因重组;若两者较近,重组机会较少。重组DNA和分子克隆技术的出现,发现了许多遗传标记——多态位点,利用某个拟定位的基因是否与某个遗传存在连锁关系,以及连锁的紧密程度就能将该基因定位到染色体的一定部位,使经典连锁方法获得新的广阔用途,成为人类基因定位的重要手段。
染色体上两个位点从亲代传给子代时,若相距1cM,就有1%的重组机会。整个人类基因组含3.2×109bp,相应约有3300cM,每个染色体平均约有150cM,1cM约为1000kb。因此,一个致病基因和标记位点紧密连锁,二者不须在同一条染色体的同一区段,一条染色体可以产生大量的DNA多态,只要提供足够的家系,按孟德尔方式遗传的疾病都可将其基因定位。
图7-3表示某一致病基因与一多态位点的关系。父(Ⅰ1)是显性遗传病患者,基因型为DN,他妻子(Ⅰ2)正常,基因型为NN,多态标记位点父为Aa,母为AA,在子代中,除Ⅱ4外,都是致病基因与多态标记位点的完全连锁,即都遗传了父亲的A基因和D基因,或是a基因和正常N基因。据此信息,就可确证父亲的致病基因是多态标记A基因连锁在同一染色体上,而Ⅱ4则是重组体,而具有标记基因A的个体并不都是患者,Ⅰ2就是这样,所以,在连锁分析中,多态标记是极为有用的。

图7-3 致病基因与标记位点的边锁关系图
在人类基因组中还存在约50000-100000个串联重复序列家族,它们均匀穿插于基因组,平均50kb有一个,这些都是很好地遗传标记对突变的检测和基因定位研究起了重要作用。正如本章开始提到,至1993年10月已经发现多态标记总数为5964个,从分子水平进行基因定位,还有不少有效的新技术,它们相互配合使用,使基因定位得到迅速发展。此外,利用染色体自身结构及染色体畸变法进行缺失作图和基因剂量法等。总之,人们已不只是用单一技术进行基因定位,而是将细胞、染色体和分子水平技术结合起来,综合分析,互相印证,以达快速、准确的目的。