第二节 补体调节分子的结构及功能
补体系统的激活为一种级联反应,但受到多种调节分子的严格控制,其反应的程度和单一成分的反应都是在生物反馈近代制下而进行的,从而限制了活化的扩大化,以维持补体水平的平衡。调节作用包括两个方面,即自身衷变失活及一些抑制物的灭活作用。前者指已活化的补体分子均不稳定,如不及时与靶细胞膜结合即迅速衰变失活;后者是通过抑制物的作用而使已活化的分子失去活性。这一节中仅涉及后一个方面。
一、C1抑制物
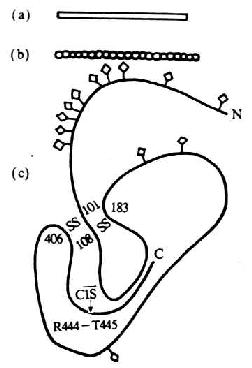
C1抑制物(C1INH)是血清中高度糖基化的一种蛋白质,含糖量高达35-49%。最初由Ranoff和lepow(1957)所发现,称其为C1酯酶抑制剂,与引同时Schultze等则将其称为α2神经氨酸糖蛋白。C1INH为一单链分子,由478个氨基酸残基组成,分子量为104kDa,由478个氨基酸残基组成,分子量为140kDa,链内有两对二硫键(图5-13)。C1INH调节的主要方式是,与活化的C1r或C1s结合形成稳定的复合物而导致C1丝氨酸蛋白酶失活。其作用机理是,C1INH通过提供一个酷似C1r或C1s的正常底物的序列为“锈铒”(“bait”),被c 1r或C1s裂解暴露出一个活性部位,然后再与C1r或C1s结合形成共价的酯键而发挥抑制作用。此外,C1INH还可防止在缺乏抗体时,C1以很低但仍有一定速率出现的自发激活。正常情况下,血液中的大多数C1可被7倍于其克分子浓度的C1INH所结合,以防止C1由于构象改变而引起的自发激活。但C1同抗原、抗体复合物的结合,可使C1从C1INH的抑制作用中而获释。除上述作用外,C1INH还可抑制凝血因子Ⅻa、Ⅺa、激肽释放酶及纤溶酶,因而其在凝血、激肽和纤溶系统中也有重要的调节作用。
经对C1INH cDNA序列的分析发现,C1INH与其它几种丝氨酸蛋白酶抑制物(serpin)超家族成员(α1抗胰蛋白酶、α1抗糜蛋白酶及抗凝血酶Ⅲ等)约有30%的氨基酸同源性,物别是在C端的120个氨基酸。C1INH的编码基因定位于第11号染色体的短臂11.2~长臂13亚区。C1INH先天性缺陷时,可导致遗传性血管神经性水肿(hereditary angioneurotic edema,HAE)。近年报道应用C1INH浓缩剂防治HAE效果良好,但尚未广泛用于临床。

图5-13 C1 INH分子的结构模式图
注:(a)为电镜观察模式图
(b)为中子散射模式图
(c)为园二色谱分析的二级结构模式图