第五章 补体的分子生物学
补体系统由30多种蛋白分子所组成,是迄今所知机体中最复杂的一个限制性蛋白水解系统(limited proteolysis system),根据各成分功能不同,将它们分为三组。第一组为补体系统的固有成分共14个蛋白分子。即C1(含三个亚组分:C1q、Clr和Cls)、C4、C2、C3、C5、C6、C7、C8、C9、B因子、D因子和P因子。其中C1、C4和C2仅参与经典激活途径的活化;B因子、D因子和P因子仅参与替代途径的反应;C5-9则为上术两条激活途径共同的末端效应序列。第二组为调节与控制补体系统活化的分子,包括:C1抑制物(C1INH),C4结合蛋白(C4bp)、膜辅因子蛋白(MCP)、促衰变因子(DAF)、蛋白S(PS)、H因子、Ⅰ因子、血清羧肽酶N、S蛋白、CD59、SP40/40及同种限制因子(HAF),又称C8结合蛋白(C8bp)。第三组为补体的受体分子,有C1q受体(C1q-R)、I型补体受体(CR1)、Ⅱ型体受体(CR2)、Ⅲ型补体受体(CR3)、Ⅳ型补体受体(CR4)、Ⅴ型补受体(CR5)、H因子受体(fH-R)及C3a受体(C3a-R)和C5a受体(C5a-R)等。
在正常生理情况下,绝大多数补体固有分子均以非活化形式存在于血清中,当受到某种激活剂作用后,即出现一系列级联反应,各种补体固有分子依次活化,最终产生溶细胞性效应。补体分子在活化过程中,可不断形成具有酶活性的中间复合体(如C4b2a,C4b2a3b,C3bBb及C3(b)nBb等),裂解有关的补体分子产生多种活性肽和蛋白片段,发挥不同的生物学效应。但补体系统的级联活化反应,又受着各种调节分子的严格控制,借以限制补体活化的程度及维持体内补体水平的平衡。
补体系统的主要生理功能是促进吞噬和溶解靶细胞。因此,是机体免疫防御机制的重要组成部分,对消除外来抗原的侵害,维护机体内环境的平衡具有重要作用。但另一方面,在一些非免疫性因素的刺激下,补体系统的活化又可产生炎症反应,并影响凝血及纤溶系统,导致机体正常组织细胞的损伤。因此,补体既是生理性的防御物质,又是造成病理性损伤的介质。
80年代以来,由于分子生物学技术的进展,已对绝大多数补体分子的基因克隆成功,并揭示了它们的核苷酸和氨基酸序列,从而为研究补体系统各成分的结构及功能创造了有利的条件。本章将着重介绍各种补人本蛋白的结构及其功能。
第一节 补体固有成分的分子结构及功能
补体系统两条激活途径中,涉及到14个补体蛋白(C1-9,及B、D、P因子)的参与。近年来,由于分子遗传学和分子克隆技术的应用,已阐明许多补体分子的结构、功能、生物合成及遗传特征,从而大促进了人们对补体系统激活过程机理的认识和对各个补体分子功能的深入了解。
一、C1分子
C1是经典激活途径中的起始成分。它是由1个分子的C1q和2个分子的C1r及2个分子的Cls借Ca2+连接而成的大分子复合物。分子量约为750kDa。其中C1q为具有识别作用的亚单位,C1r和C1s为具有催化作用的亚单位。
(一)C1q
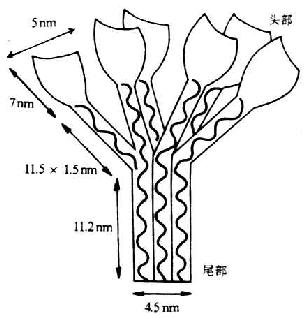
C1q为各种补体分子中分子量最大(410kDa)的γ球蛋白。其分子结构较特殊和复杂,由A、B、C三种不同类型的肽链所组成。其中A、B、C链各6条,共18条。A、B、C三种肽链的分子量不尽相同,分别为24、23和22kDa,各含有222-226个氨基酸残基,且彼此同源。每条肽链由含半胱氨酸残基的一个短的N末端区所组成,接着为一段81个氨基酸的胶原序列(即重复的三股序列Gly-X-Y,Y处通常为羟脯氨酸或赖氨酸残基)。该序列的其余部分为非胶原性的。A、B链间及两条C链间各有一个二硫键相连接。18条肽链中每三条不同的肽链组成一条三股螺旋,故共有6条这样的结构。每条螺旋的肽链均由丝状胶原样成分组成。在6条螺旋结构C端由于氨基酸序列的随机卷曲而形成6个花蕾状的球形头部,呈花朵形展开。在近N端约为1/2全长的螺旋结构呈束状并平行排列,其N末端为C1q的尾部。因此在电镜下观察,C1q分子的图像酷似一束盛开的郁金香花(图5-1)

图5-1 C1q的结构(模式图)
C1q的胶原样区有结合C1r和C1s的部位。并证实聚合的C1q刺激B细胞增强其产生Ig的作用,也是通过其尾部而完成的。C1q的关部含有能识别IgFc片段上补体结合部位的位点(C1q与C1q-R相互作用),且由于6个球形头部呈花朵形展开,更增加了其与Ig接触的机会。C1q同1个分子的IgM结合即可被活化,但至少需同两个IgG分子结合才能被活化,而且两个IgG分子在细胞膜上的距离不得少于700nm。C1q对人4种IgG亚类的结合亲和力依次为:IgG3>IgG1>IgG2>IgG4。
Reid等已对C1q分子的A、B链做了部分氨基酸分析,并完成了A、B链的cDNA克隆及序列分析。因此,C1q分子的大部分一级结构已经明确。编码C1qA、B、C三条肽链的基因均定位于人的第1号染色体的短臂34.1-36.1区。
(二)Clr和Cls
Clr和Cls均为单一多肽链分子,又都是丝氨酸蛋白酶(原)。Clr和Cls 多肽链均由接近700个氨基酸所组成。位于C末端的约250个氨基酸为丝氨酸蛋白酶区,与胰蛋白酶和糜蛋白酶同源。同大多数补体蛋白一样,它们都是镶嵌(mosaic)蛋白,即由不同氨基酸组成的固定基序组合而成,并且很可能代表独立的折叠功能区或结构功能域(module)。
电镜下观察表明,Clr和Cls的分子构型极为相似,均呈一端大一端稍小的哑铃状分子。

图5-2 Clr/Cls分子的结构
两个分子的Clr和同等分了的Cls借Ca2+连接成扭曲的“8”字形,盘架于C1q近头部的6条螺旋结构间(图5-3)。Clr和Cls的分子量条螺旋结构间(图5-3)。Clr和Cls的分子量均为85kDa。它们激活后,在分子内的精氨酸与亮氨酸残基间断裂,形成分子量分别为57kDa和28kDa的A、B两个片段,但链间仍以二硫键相连接,故整个分子并末分离。在B片段上含有丝氨酸蛋白酶活性点,为其催化英勇区(图5-2)。A片段上有Clr和Cls相互反应的的功能区。反应功能区朝向中心,催化功能区位于外侧。在一般C1INH与C1r结合着,而一旦有免疫复合物结合到Clq时,C1INH的抑制作用即行移除,并通过C1q的胶原性柄将其头部的移动传递到其核心区,并从此处再传递到与其相连接的C1r,诱导C1r构钟爱改变并裂解活化。活化的C1r(C1r),再作用于C1s使之成为活化型C1s(C1s)。

图5-3 C1分子(C1q、C1r和C1s)的结构(示意图)
目前C1r和C1s的cDNA克隆均已成功,并进行了全部序列分析。编码C1r的基因定位于人的第12号染色体短臂13-ter,与编码C1s的基因相连。