鼠 人
(CSF-1)
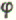 吞噬和细胞毒功能,ADCC,促进IL-1、TNF-α的产生
吞噬和细胞毒功能,ADCC,促进IL-1、TNF-α的产生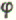 、Mo、PMN、Eo的数量,提高吞噬功能
、Mo、PMN、Eo的数量,提高吞噬功能(同源二聚体)
二、集落刺激因子(CSF)
骨髓造血干细胞体外半固体培养技术的建立和重组集落刺激因子(colony-stimulating factor,CSF)的问世给集落刺激因子的研究提供了前提。根据细胞因子刺激不同造血细胞系或不同分化阶段的细胞在半固体培养基中形成不同细胞集落,分别命名为粒细胞CSF(G-CSF)、巨噬细胞CSF(M-CSF)、粒细胞和巨噬细胞CSF(GM-CSF)、多重集落刺激因子(multi-CSF,又称IL-3)、干细胞因子(SCF)、红细胞生成素(EPO)。有人将IL-5称为嗜酸性粒细胞集落刺激因子(Eo-CSF)。此外,IL-1、IL-6和IL-11在骨髓多能干细胞早期的分化中也有重要的作用。
(一)IL-3
1981年Ihle等发现ConA刺激小鼠脾细胞的培养上清中含有一种因子,能提高裸鼠脾脏淋巴细胞成熟淋巴细胞标志20-α-羟固醇脱氢酸(20-α-hydroxysteriod dehydrogenase,20αSDH)的阳性率,命名为白细胞介素3(interleukin-3,IL-3)。由于IL-3可刺激多能干细胞和多种祖细胞的增殖与分化,又称为多重集落刺激因子(multi-colony stimulating factor,multi-CSF)。
1.IL-3的产生 主要由活化T细胞或T细胞克隆产生。小鼠髓样单核细系(myelomonocytic cell line) WEHI-3B细胞系可自发产生一定水平的IL-3。此外,胸腺上皮细胞、活化小鼠肥大细胞等也可表达IL-3。
2.IL-3的分子结构和基因 1984年美国和澳大利亚分别从ConA刺激小鼠T细胞和WEHI-3B细胞中提取高活性部分mRNA,逆转录成cDNA,进行克隆化和DNA序列分析。编码小鼠IL-3和GM-CSF的基因都定位于第11号染色体。IL-3的基因组由5个外显子和4个内含子组成。cDNA编码166氨基酸残基,N端26氨基酸残基为信号肽,此外N端另有数个氨基酸残基可能被血清蛋白酶所切除。成熟小鼠IL-3由131氨基酸残基组成,含有糖基,分子量为25~28kDa。
1986年美籍华人杨育中从长臂猿T白血病细胞株MLA144中提取IL-3mRNA,成功地获得长臂猿IL-3cDNA(gIL-3cDNA),后又用gIL-3cDNA作为探针筛选人IL-3基因组DNA,并克隆成功。人IL-3基因结构与小鼠相似,由5个显子和4个内含子组成,人与鼠IL-3DNA约有45%同源性,氨基酸有29%同源性,但人鼠间IL-3生物学作用无交叉反应。人和长臂猿IL-3有高度同源性,成熟的IL-3分子都由133个氨基酸残基组成,仅11个氨基酸残基不同,在第16位和84位上2个半胱氨酸残基在分子内形成二硫键,此外还有2个N糖基化点 。在体外糖基不影响IL-3的生物学活性。hIL-3启动子上游调控区含有多个转录调控子同源位点,其中AP-1(TGAGTCA)位于-301处,CREB(TTACGTCT)位于-147处,NFAT-1(GATGAATAAT)位于-156处,CK-1(GAAGGTTCCA)位于-126处,CK-2(TCAGATAA)位于-115处。hIL-3转录调控主要受上游两个顺式调控区的调控。第一个位于-121到-161之间,它对于hIL-3转录激活最为重要,其间除含有CREB、NFAT-1外,新发现了对hIL-3表达起决定作用的转录调控蛋白结合位点,该位点被命名为NF-IL-3-A(ATGAATAA)。第二个调控区位于-301处的AP-1位点,AP-1位点能强有力地增强hIL-3基因的转录。此外,最近还发现了hIL-3转录抑制调控区,位于-250和-271之间,称为NIP位点。目前认为位于其上游-301处AP-1对hIL-3的转录增强作用是通过消除NIP对hIL-3基因转录的抑制来实现的。
人IL-3以及IL-4、IL-5、IL-13、GM-CSF、M-CSF、M-CSF受体(c-fms编码产物)、PDGFR(血小板衍生的生长因子受体)、β2-肾上腺素能受体(β2AR)、内皮细胞生长因子(ECGF)和CD14的基因都定位于第5号染色体。这种在一定区域内连锁的现象可能与协同调节造血过程有关,并可能与骨髓发育异常综合征(myelodysplastic syndrome,MDS)、原发性急性非淋巴细胞白血病(acute nonlymphocytic leukemia,ANLL)、顽固性巨幼红细胞贫血等疾病的发病有关。
3.IL-3受体 分子量为140kDa,属于红细胞生成素受体超家族成员,而且具有2个该家族的结构域,IL-3R胞浆区是酪氨酸激酶的底物。有关IL-3Rβ链参见本节GM-CSF受体和本章第三节。
4.IL-3的生物学活性 IL-3与其它集落刺激因子的生物学作用见表4-4。除具有多重集落刺激作用外,最近发现IL-3可刺激皮肤上皮细胞、CD4-CD8-TCRαβ细胞、肥大细胞、嗜碱性粒细胞的增殖,阻止肥大细胞发生程序性细胞死亡。
(二)GM-CSF
1977年Burgess等从小鼠肺条件培养液中发现一种能刺激粒细胞和巨噬细胞形成集落的因子,命名为粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)。1984年和1985年小鼠和人GM-CSF的cDNA分别克隆成功。
1.GM-CSF的产生 T细胞、B细胞、巨噬细胞、肥大细胞、内皮细胞、成纤维细胞等均可产生GM-CSF。其中T细胞和巨噬细胞一般在免疫应答或炎症介质刺激过程中直接产生;而内皮细胞、成纤维细胞可能通过IL-1和TNF的诱导而产生。
表4-4 CSF的生物学功能及临床应用
| CSF | 分子量(kDa) 鼠 人 |
主要产生细 胞 | 主要集落刺激作用 | 促进吞噬细胞功能 | 临床治疗疾病 | 使用情况 | 基因定位 | 外显子/内含子 | 人与鼠同源性(%) | 人与鼠活性交叉 | 糖基化 |
| G-CSF(CSF-β) | 25 30 | Mo,En,Fb | 髓样、中性粒细胞集落增殖、分化成熟 | PMN的吞噬和杀伤功能,ADCC | 增加化疗作用,艾滋病,白血病,再生障碍性贫血、癌症,骨髓移植 | FDA已批准 | 17q11~q13 | 5/4 | 73 | + | 0- |
| M-CSF (CSF-1) |
70 45(同源二聚体) | Mo、En、Fb | 前单核、单核 | M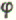 吞噬和细胞毒功能,ADCC,促进IL-1、TNF-α的产生 吞噬和细胞毒功能,ADCC,促进IL-1、TNF-α的产生 |
Ⅰ期临床试验 | 5q23~q31 | 80 | + | N- | ||
| GM-CSF(CSF-α,CSF-2) | 23 22 | Tact、Fb、En、Mo | 多能干细胞、髓样干细胞、单核、嗜酸、中性粒细胞增殖 | 增加M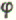 、Mo、PMN、Eo的数量,提高吞噬功能 、Mo、PMN、Eo的数量,提高吞噬功能 |
二次化疗所致中性粒细胞减少症,异体和自体骨髓移植,再生障碍性贫血,烫伤骨髓功能衰竭,血小板减小 | FDA已批准 | 5q23~q31 | 4/3 | 54 | - | N- |
| IL-3(multi-CSF) | 25 18 | Tact | 多能干细胞、多种定向祖细胞、前髓、髓样、红样、巨核、前单、单核、中性、嗜酸、肥大细胞 | 体内注射IL-3增加外周血中PMN、Mo、Eo的数量,促进Eo ADCC | Ⅰ、Ⅱ期临床试验 | 5q23~q31 | 5/4 | 29 | _ | N- | |
| EPO | 30 30-34 | 肾基质细胞 | 红细胞系 | 促进BFU-E、CFU-E以及红系的增殖和分化 | 贫血 | FDA已批准 | 7q11~q22 | 5/4 | 80 | + | N-/0- |
| SCF | 31×2
(同源二聚体) |
肝细胞 | 干细胞、造血祖细胞、髓系、红系、巨核细胞系 | 干细胞增殖和分化,与IL-3、G-CSF、GM-CSF和EPO有协同作用 | 癌症 | Ⅰ期临床试验 | 80 |
Mo:单核细胞;M :巨噬细胞;Eo:嗜酸性粒细胞;En:内皮细胞;Fb:成纤维细胞;Tact:活化T细胞
:巨噬细胞;Eo:嗜酸性粒细胞;En:内皮细胞;Fb:成纤维细胞;Tact:活化T细胞
表4-5 产生GM-CSF的细胞和刺激物
| 细胞种类 | 刺激物 |
| 生理性GM-CSF主要来源 | |
| T淋巴细胞 | 抗原、外源凝集素、CD28McAb、IL-1、HTLV |
| B淋巴细胞 | LPS、TPA |
| 巨噬细胞 | LPS、FCS、吞噬作用、粘附作用 |
| 成纤维细胞 | TNF、IL-1、TPA |
| 内皮细胞 | TNF、IL-1、TPA、修饰的LDL |
| 间皮细胞 | EGF+TNF |
| 成骨细胞 | PTH、LPS |
| 病理性GM-CSF主要来源 | |
| AML | TNF、粘附、IL-1 |
| 类风湿性关节炎滑膜 | |
| 实体瘤 |
注:PTH:甲状旁腺激素
2.GM-CSF的分子结构和基因 人和鼠GM-CSF基因DNA序列有高度同源性,基因组约2.5kb长,包括4个外显子和3个内含子。小鼠GM-CSF基因位于11号染色体。在人则位于第5号染色体长臂,在IL-3基因下游9kb处,此外,人的IL-4、IL-5、M-CSF、M-CSF受体(C-fms)和早期生长应答基因-1(early growth response gene-1,EGR-1)也位于第5号染色体的长臂(表4-6)。
表4-6 人第5号染色体上某些生长因子、受体和CD抗原的基因
| 细胞因子 | IL-3、IL-4、IL-5、IL-13 |
| M-CSF、GM-CSF、ECGF | |
| 受 体 | M-CSFR(C-fms) |
| PDGFR、β2AR | |
| CD抗原 | CD14、CD49a、CD49b |
| 其 它 | EGR-1 |
人和小鼠GM-CSF基因以及其它某些淋巴因子基因上游区TATA盒上游330bp有较高的同源性,包括一个富含GC的区域和一个10个核苷酸同一的序列(decanucleotide consensus sequence),这一序列也见于人或小鼠IL-2和IL-3基因的promoter中。此外,CK-1(cytokine consensus-1)或称保守的淋巴因子元件1(conserved lymphokine element 1,CLE-1)在小鼠或人G-CSF、GM-CSF、IL-2和IL-3的基因组中均可见到;而CK-2仅见于人或小鼠GM-CSF和IL-3的基因组中。
人和小鼠GM-CSF分别由144和141氨基酸残基组成,均包含17氨基酸的先导序列。成熟的人和小鼠GM-CSF分子分别由127和124个氨基酸残基组成,在氨基酸水平上有54%同源性,但生物学作用具有种属特异性。GM-CSF含有高度保守结构的2个链内二硫键,其中51个与93位之间形成的二硫键对该因子的生物学活性有重要作用。人GM-CSF分子中第21~31和78~94氨基酸残基对刺激造血功能极为重要,而糖基无论在体内或体外对GM-CSF的生物效应似乎无影响。
用GM-CSF转基因小鼠造血细胞为研究模型,发现这类小鼠有高水平的GM-CSF,同时伴有许多细胞组织的损伤。自分泌GM-CSF的造血细胞同时转录IL-1α、TNF和FGF(成纤维细胞生长因子)mRNA。
13.GM-CSF的生物学活性 GM-CSF有多种生物学活性(表4-4和4-7)。
表4-7 GM-CSF的生物学活性
| 体外实验 | |
| 刺激细胞增殖 | 骨髓细胞,粒细胞,巨噬细胞祖细胞,红样,巨核细胞祖细胞,AML,白血病细胞系,BFU-E,内皮细胞,单核-巨噬细胞,淋巴细胞,骨髓来源树突状细胞祖细胞,成骨肉瘤细胞,腺癌细胞 |
| 促进功能 | |
| 中性粒细胞 | 存活和蛋白合成,移动抑制,氧化代谢,脱颗粒,细胞因子分泌,再循环,IgA介导吞噬作用,ADCC吞噬和杀死病原体,表面受体调变,花生四烯酸释放,白三烯和PAF合成 |
| 嗜酸性粒细胞 | 存活,细胞毒,白三烯合成 |
| 嗜碱性粒细胞 | 组胺释放 |
| 巨噬细胞 | 细胞因子合成(如IL-1、TNF-α),杀灭寄生虫,表面受体、抗原表达,杀灭肿瘤,粘附,氧化代谢 |
| 朗罕氏细胞 | 成熟,存活力和功能 |
| 体内 | |
| 促进造血,嗜酸细胞增多 | |
| 降低血清胆固醇 | |
| 髓样细胞增殖综合征 | |
| 失明和肌肉炎细胞浸润(转基因动物) |
有报导GM-CSF和IL-3的融合蛋白可明显增强造血功能,如融合蛋白PIXY321与同时表达GM-CSFR和IL-3R细胞株结合,亲和力增加5~10倍,促进细胞增殖作用是GM-CSF加IL-3作用的10倍,刺激BFU-E、CFU-E、CFU-GM、CFU-GEMM造血细胞集落作用比单独使用IL-3、GM-CSF或两者联合应用要高10~20倍。
4.GM-CSF受体 人和小鼠 GM-CSFR均由α、β两条链组成,单独α链与配体的结合为低亲合力,β链单独不结合配体,但与α链共同组成高亲和力受体,在信号转导中起主要作用。GM-CSFR。α、β两条链胞膜外结构均属于造血因子受体超家族(或称红细胞生成素受体超家族)成员。已证实GM-CSFRβ链为IL-3、IL-5受体所共用,但在人和小鼠β链的共同情况有所差异。
(1)小鼠GM-CSFR:α链又称STH分子,由包括信号肽在内的396个氨基酸组成,成熟分子约70kDa,与IL-3结合为低亲和力,Kd值4×10-8M。小鼠GM-CSFr β链有AIC2A和AIC2B两种分子,其中AIC2A为GM-CSFR所特有,AIC2B则为GM-CSFR、IL-3R、IL-5R所共有。β链与GM-CSFRα链组成高亲和力受体,Kd为3×10-10M。AIC2A由包括信号肽在内878个氨基酸组成,成熟分子120kDa,糖蛋白,胞浆部分413个氨基酸,不含激酶结构,但可被酪氨酸激酶磷酸化,在信号转导过程中发挥重要作用。
(2)人GM-CSFR:α链为低亲和力受体。人β链又称KH97分子,与小鼠GM-CSFr β链AIC2B有56%同源性,人GM-CSFR β链cDNA编码897个氨基酸,成熟分子120kDa,有16个氨基酸的先导序列,胞膜外区422个氨基酸,穿膜区26个氨基酸,胞浆区433个氨基酸,β链为IL-3、IL-5、GM-CSF受体所共用,其信号转导与酪氨酸磷酸化有关,有关信号转导机理参见本章第三节。
(3)GM-CSFR的分布:GM-CSFR主要分布于髓系细胞,但分布的方式有所不同。在中性粒细胞表面仅有GM-CSFR的α和β链,而无IL-5R和IL-3R的α链,因而IL-3、IL-5对GM-CSF与中性粒细胞表面GM-CSFR结合不发生竞争,由于α链数目少于或等于β链的数目,所以中性粒细胞表面仅有高亲和力GM-CSFR,而无低亲和力受体。IL-3、GM-CSF两种细胞因子均可作用于单核细胞,而且可以相互竞争结合。单核细胞可同时表达IL-3、GM-CSF的高亲和力受体,也表达这两种低亲和力受体,提示在单核细胞表面这两种细胞因子受体α链表达的数目多于β链。在嗜酸性粒细胞表面同时表达IL-3、IL-5和GM-CSF三种受体,而且IL-3、IL-5和GM-CSF三种配体均可相互竞争抑制。嗜碱性粒细胞亦具有这三种受体,但结合相应配体的能力依次是GM-CSF>IL-3>IL-5。
(三)G-CSF
1.G-CSF的产生 内毒素、TNF-α和IFN-γ可活化单核细胞和巨噬细胞产生粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)。此外,成纤维细胞、内皮细胞、星状细胞和骨髓基质细胞等在LPS、IL-1或TNF-α刺激活化后也可分泌G-CSF。某些白血病细胞以及CHu-2人口腔癌细胞、5637人膀胱癌细胞、MIAPa Ca-2胰腺癌细胞可组成性地表达G-CSF。
2.G-CSF的分子结构和基因 1986年G-CSF cDNA克隆成功,G-CSF基因全长2.5kb,包括5个外显子和4个内含子,人G-CSF基因位于17号染色体,与小鼠G-CSF基因约有73%同源性,与IL-6无论在基因水平以及氨基酸水平上都有很高同源性,包括外显子、内含子组成,Cys数目,两对二硫键位置以及分子的三级结构等。小鼠G-CSF分子共含有208个氨基酸,30个氨基酸先导序列,成熟蛋白为178个氨基酸。人类有两种不同的G-CSf cDNA,分别编码含207和204氨基酸的前体蛋白,均有30个氨基酸的先导序列,成熟蛋白分子分别为177和174个氨基酸,前者除了在成熟分子N端35位处插入了3个氨基酸外,其余的序列与174氨基酸分子相同。人G-CSF分子量为19.6kDa,PI6.1,O-糖基化,对酸碱(pH2~10)、热以及变性剂等相对较稳定。G-CSF有5个半胱氨酸,Cys 36与Cys42,Cys74与Cys64之间形成两对二硫健,Cys17为不配对半胱氨酸,二硫键对于维持G-CSF生物学功能是必须的因素。人和小鼠G-CSF在氨基酸水平有73%同源性,并具有相互交叉的生物学活性。
3.G-CSF受体 1990年G-CSF受体cDNA克隆成功,基因组16.5kb长,有17个外显子。G-CSFR为高亲和力受体,表达在造血祖细胞和中性粒细胞、胎盘细胞、内皮细胞和髓样白血病细胞株如HL-60细胞等,每个中性粒细胞有300~1000个G-CSFR,Kd为100pM。小鼠G-CSFR是高度糖基化的,含812个氨基酸。膜型G-CSFR包括胞膜外区、穿膜区和胞浆区。胞膜外区含有3个区域:(1)N端1个Ig样区;(2)1个红细胞生成素受体超家族结构域,这是识别G-CSF配体的部位;(3)三个串连的Ⅲ型纤维粘连素(fibronectin)结构区。人G-CSF R含813氨基酸,与小鼠G-CSFR有62%同源性。此外,人G-CSFR还有一种759氨基酸的异型(isoform),这种异型G-CSFR除C端序列不同外,其它部分与前者相同。G-CSFR还可以可溶性形式(sG-CSFR)存在于体液中。
4.G-CSF的生物学作用 G-CSF主要作用于中性粒细胞系(lineage)造血细胞的增殖、分化和活化。在体外G-CSF刺激骨髓造血祖细胞中中性粒细胞集落的形成,延长成熟中性粒细胞的存活时间,活化中性粒细胞,促进其ADCC,超氧阴离子的产生和碱性磷酸酶的合成。最近研究表明,单独G-CSF或与SCF协同可促进多能造血干细胞的增殖、干细胞母细胞集落形成以及体内CFU-S的形成。G-CSF还具有对人粒细胞、单核细胞、成纤维细胞、平滑肌细胞以及成肌纤维细胞的趋化作用。肿瘤患者注射G-CSF后可提高血循环中中性粒细胞的水平,这种作用可能与缩短某些骨髓细胞进入S期的时间以及增加生成粒细胞的祖细胞数量有关。
(四)M-CSF
巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)又称CSF-1,最初发现其存在于血清、尿或其它体液中,能刺激骨髓造血祖细胞巨噬细胞集落的形成。
1.M-CSF的产生 多种细胞均可产生M-CSF,包括:成纤维细胞、子宫内膜中分泌型上皮细胞、骨髓基质细胞、脑星状细胞、成骨细胞;LPS等激活的巨噬细胞、B细胞、T细胞和内皮细胞等;此外,多种肿瘤细胞如原粒细胞性白血病、淋巴母细胞性白血病、肺腺癌细胞、乳腺癌和卵巢癌等。
2.M-CSF分子的结构和基因 人和小鼠天然M-CSF为糖蛋白,由二硫键连接的同源双体,分子量40~90kDa。人M-CSF前体长度554~256个氨基酸不等,均有32个氨基酸的信号肽和23个氨基酸的穿膜部分。膜结合型M-CSF表达在单层培养的成纤维细胞,可刺激表达M-CSF受体的巨噬细胞的粘附和增殖。成熟M-CSF分子靠近N端150氨基酸在与M-CSF受体结合中起关键作用,人和小鼠M-CSF分子这个区域结构高度保守,其同源性达80%。
3.M-CSF受体 M-CSFR由c-fms原癌基因所编码。人和小鼠M-CSF和M-CSF受体基因分别定位于第5和第11对染色体,与GM-CSF、IL-3、IL-4、IL-5、IL-13和酸性FGF基因密切连锁。M-CSF受体为高亲和力,表达于循环的单核细胞和组织巨噬细胞以及胎盘滋养层细胞。人M-CSFR为穿膜糖蛋白,胞膜外区512个氨基酸,组成5个免疫球蛋白样区,穿膜区25个氨基酸,胞浆区435个氨基酸,并具有蛋白酪氨酸激酶区。通常M-CSFR是以同源二聚体形式存在。
4.M-CSF的生物学作用 M-CSF主要的生物学作用是促进单核-吞噬细胞包括破骨细胞在内的存活、增殖和活化。妊娠妇女尿中M-CSF水平明显增加,可能与胎盘的形成有关。M-CSF是炎症反应中的介质,并可提高巨噬细胞杀伤肿瘤细胞和微生物的能力。人M-CSF可作用于小鼠,而小鼠的M-CSF生物学作用则具有种属的特异性。
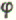
图4-3 细胞因子与造血细胞分化
合理应用重组人M-CSF有助于提高机体免疫应答水平,现已用于治疗某些肿瘤,提高化疗后总白细胞和粒细胞水平,还可治疗小儿慢性中性粒细胞减少症。
M-CSF可能与某些癌症、全身性红斑狼疮和骨质疏松症等疾病发生有关。白血病、淋巴细胞恶性增生、骨髓及外骨髓增殖性疾病、卵巢癌、子宫内膜癌、全身性红斑狼疮以及免疫性血小板减少性紫瘢病人血清或血浆中M-CSF的水平可升高。
(五)SCF
干细胞因子(stem cell factor,SCF)又称肥大细胞生长因子(mast cell growth factor,MGF),最初是从Buffalo大鼠肝细胞系中cDNA克隆成功,在小鼠MGF基因位于第10号染色体SL基因,是C-kit的配体(C-kit ligand,KL),因此也称之造血生长因子KL。
1.SCF的产生 主要由肝细胞产生。
2.SCF的分子结构 人和小鼠SCF分别由248和220个氨基酸组成,约有80%同源性。SCF可以可溶性和膜结合两种形式存在,可能与SCf mRNA剪接或蛋白酶切割位点不同有关。在体内SCF以非共价相连同源二聚体形式存在,单体分子量约31kDa,单体中含有4个半胱氨酸残基,形成分子内二硫键。糖基对SCF生物学活性并非必需。
3.SCF受体 SCF受体即是C-kit,成熟SCF受体分子由953个氨基酸组成,其中胞膜外区497个氨基酸,属免疫球蛋白超家族成员,组成5个Ig样的结构域,与M-CSFR、PDGFR有较高的同源性;穿膜区由23个疏水性氨酸组成;胞浆区433个氨基酸,含有酪氨酸激酶和自身磷酸化的结构域。SCFR表达于多种干细胞、集落形成细胞和肥大细胞等。
4.SCF的生物学作用
(1)促进IL-3依赖的早期造血前体细胞的增殖和分化,可以IL-3、G-CSF、GM-CSF和EPO等细胞因子协同促进髓样、淋巴样和红细胞样细胞的产生。
(2)促进肥大细胞增殖。
(3)促进黑素母细胞(melanoblasts)的增殖。
SCF在骨髓移植、造血功能障碍以及干细胞基因治疗中有潜在的应用价值。目前SCF已进入临床Ⅰ期试验,主要治疗乳腺癌和淋巴瘤病人。
(六)EPO
红细胞生成素(erythropoietin,EPO)是一种刺激红细胞产生的糖蛋白。
1.EPO的产生
(1)肾脏是EPO产生的主要来源,产生EPO细胞为肾小管基底膜外侧的肾小管周围间质细胞(peritubular interstitial cell),由于这些细胞释放第Ⅷ因子,因此这种EPO产生细胞可能是一种肾小管周围毛细血管的内皮细胞。组织氧利用率下降所引起组织缺氧是诱导EPO产生的主要刺激因素。
(2)肝脏中枯否氏细胞
(3)骨髓中巨噬细胞
2.EPO的分子结构和基因 人和小鼠EPO基因分别定位于第7和第5号染色体。人EPO基因组为单拷贝,5.4kb长,有5个外显子和4个内含子。EPO基因上游有TATA盒,5′UTR处有AP-1、SP-1、NF-IL-6、GRE和NF-κB的结合序列。EPo cDNA编码193个氨基酸,包括27个氨基酸先导序列,成熟EPO分子由166个氨基酸组成,分子量为18kDa,在CHO细胞中表达rEPO为30kDa ,糖占39%,在人尿中的EPO为34kDa糖蛋白。
3.EPO受体 1989年从MEL细胞745表达文库中EPORcDNA克隆成功。人EPOR基因位于19号染色体,裸肽分子量为55kDa,糖基化后为66kDa,由508个氨基酸残基组成,包括24氨基酸残基的先导序列,成熟EPOR为484个氨基酸残基,其中,胞膜外区226,穿膜区22,胞浆区236个氨基酸残基,胞膜外结构属红细胞生成素/细胞因子受体超家族。还可能存在着66kDa与其它膜分子的复合物。EPOR有高亲和力和低亲和力两种,至今对EPOR组成的确切结构和信号转导还不清楚。目前至少已发现3种在自然状态下由于膜受体裂解脱落的可溶性EPO受体(sEPOR)。
4.EPO的生物学作用 EPO特异地作用于红细胞样前体,对其它细胞系几乎没有作用。EPO刺激骨髓中红细胞样前体细胞产生红细胞样集落形成单位(colony-forming unit-erthroid,CFU-E)和红细胞样爆发形成单位(burst-forming unit-erythroid,BFU-E)。CFU-E为迅速分裂的红细胞样前体细胞,对低浓度EPO即有反应;BFU-E则为更不成熟的红细胞样前体细胞,对EPO反应后,其分裂速度较慢。
EPO水平过高见于:(1)原发性红细胞增多症;(2)继发性红细胞增多症,如高原居住者,慢性阻塞性肺疾患,紫绀性心脏病,高亲和力血红蛋白病,吸烟,局限性肾脏缺氧,恶性或良性肾脏肿瘤,肝细胞瘤,肝癌,肾上腺肿瘤等。EPO水平过低主要见于肾功衰竭或晚期肾病引起的贫血,慢性感染、类风湿性关节炎、AIDS、肿瘤引起的贫血,其他原因引起的贫血等。患上述疾病机体可能产生IL-1、TNF-α,这些细胞因子是EPO活性的抑制剂。再生障碍性贫血、缺铁性贫血、地中海性贫血、巨幼细胞性贫血等病人EPO水平反而升高,表明上述贫血症原因并非由EPO缺乏所引起。
EPO主要用于肾功衰竭引起的贫血,还可用于类风湿性关节炎、多分性骨髓瘤、非Hodg-kin氏淋巴瘤、AIDS、化疗等原因引起的贫血。1989年美国FDA批准Amgen公司首先将rEPO投放市场。
(七)CSF的临床应用
如前所述,多种CSF已广泛应用于临床治疗多种疾病,体内应用CSF可提高循环血液中的血细胞,纠正贫血,减少感染等并发症,可明显改善症状,降低病死率。其主要适应症是下列原因引起的血液细胞减少(参见表4-15和表4-16)。
(1)肿瘤化疗引起的血液细胞减少;
(2)肿瘤放疗引起的血液细胞减少;
(3)骨髓移植后重建造血功能;
(4)再生障碍性贫血以及慢性肾衰、肿瘤及血引起的贫血;
(5)艾滋病、骨髓发育异常综合征(MDS)患者血细胞减少;
(6)烧伤等。