第三节 DNA及寡核苷酸探针在原位杂交组织化学中的应用
一、DNA探针的应用
虽然一般认为DNA探针敏感度不如cRNA探针,但在病毒的检测等领域中DNA探针仍得到广泛的应用。
在原位杂交细胞化学的操作步骤方面与cRNA探针基本相同,所不同的是:(1)杂交时需先在高温80~95℃短时处理,使DNA探针及细胞内靶DNA变性,解离成单链,迅置于冰上冷却。然后置于37℃~42℃杂交过夜。(2)RNA酶的溶液的冲洗不能减低背景,因此,在操作步骤中省略此步。
(一)地高辛-碱性磷酸酶(Dig -AKP)标记DNA探针在石蜡包埋切片检测病毒DNA中的应用
1.组织前处理
(1)固定:组织以10%中性福尔马林液或Bouins液固定,常规石蜡包埋,切片厚4~6μm,粘附于涂有粘附剂的玻片上,入烤箱60~80℃6~8h,使切片更紧贴玻片。
(2)脱蜡:二甲苯10min ×2,自100%乙醇,90%,70%,50%,30%各5min。入PBS(含5mmol/l MgCl2,pH7.3~7.4)10min×2。入0.2n HCl 20min以进一步去除蛋白。
(3)50℃2×SSC,含5mmol/l EDTA溶液中30min。
(4)蛋白酶K(1μg/ml溶于0.1mol/l PBS中,)37℃20~25min。
(5)0.2mol/l 甘氨酸液:室温10min,中止蛋白酶反应。
(6)4%多聚甲醛(PBS新鲜配制):室温20min。
(7)PBS/5mmol/l MgCl2漂洗10min×2。
(8)脱水,自低浓度到高浓度,无水乙醇各3min,空气干燥。
2.预杂交封闭非特异性杂交位点,20μl/每张切片,42℃水浴半小时。
3.杂交10~20μl/每张切片,加盖硅化盖玻片,将切片置于95℃min,使探针及病毒DNA变性,然后迅速置于冰上1min(也有报告用乙醇使之冷却的),然后将切片置于盛有2×SSC湿盒内,42℃过夜(16~18h)。
4.杂交后漂洗
(1)2×SSC液内振动移除盖片。
(2)2×SSc 55℃10min×2。
(3)0.5×SSc 55℃5min×2。
(4)缓冲液II(含0.5%封阻试剂,用缓冲液I溶解)37℃30min。
(5)缓冲液I(10mmol/l Tris –HCl, 15.0mmol/L NaCl pH7.5)15min,室温。
(6)酶标地高辛抗体(1:5000,应用缓冲液I稀释)37℃30min。
(7)缓冲液i 15min×2室温。
(8)缓冲液III(100mmol/l Tris -HCl, 100mmol/L NaCl, 50mmol/L MgCl2,pH9.5)室温2min。
5.显色
(1)显色液配制:缓冲液III:1ml中加入4.5μl四氮唑蓝(NBT),3.5μl X-磷酸盐(5-溴-4-氯-3吲哚磷酸盐(BCIP配成))。30μl/每张切片,置暗处显色30min到2h。定时抽查切片,镜检其显色情况。
(2)缓冲IV(10mmol/l Tris –HCl, 1mmol/L EDTA, pH8.0)10min终止反应,甲绿复染5min,二甲苯透明,DPX封固,镜检。
(二)荧光标记DNA探针的应用
1.概述在原位杂交细胞化学中荧光标记DNA探针(Fluorescence in situ DNA hybridisa-tion , FISH)的应用在细胞培养和染色体铺片(见二十一章 )中较为广泛。FISH属于非放射性标记,其优点在于简便,快速,其敏感性可与放射性同位素标记核酸探针相等。不少实验室报告应用FISH(2~5kbp探针)可成功地达到单个拷贝(copy)的特异性定位。
2.荧光标记DNA探针应用于ISHH中的基本原则(Barbara Traok和Dan Pinkel 1990)
(1)首先应使组织或染色体中靶核苷酸高温加热变性解离为单链DNA,化学性标记的DNA探针除外。
(2)杂交:一般在37℃进行,探针稀释浓度在2ng/μl,染色体铺片探针浓度在0.4ng/μl,杂交液2~3μl/每cm2盖片,每张盖片大约1.8cm2,约需10μl杂交液。有实验室报告,如每张盖片(温度为室温)加入杂交液将会降低杂交温度所需要的37℃,因此,建议对盖片应用前在37℃进行预热。
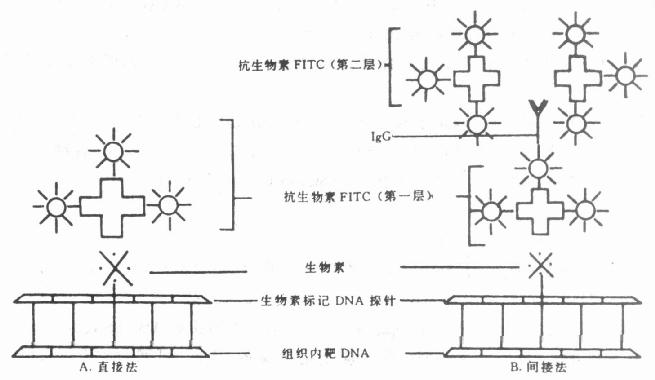
(3)用免疫细胞化学或组织化学方法显示荧光标记。自80年代以来,荧光素标记检测系统日益增加。包括:①生物素标记探针与荧光素标记的抗生物素(avidin)或抗生物素抗体。②氨乙酰基荧光(aminoacetylfluroence,AAF)-改良探针(modified probe),与抗AAF抗血清。③磺酸(sulfonatc)改良探针,以抗磺酸抗血清检测(Organic Ltd, Yavene, Israel和TMc Bioproducts Rockland ME可提供此药盒)。④汞标记探针(mercurated probe),以硫氢基(sulf hydryl)与荧光标记物或-半抗原相结合,再以抗半抗原抗血清检测。⑤地高辛标记探针,以地高辛抗血清检测(Boehringer – Manubeim Inc, Mannhein, FRG可提供此药盒)。在上述各例中,为简便可采用直接法(图20-4A),为提高敏感度可采用间接法(图20-4B)。

图20-4 生物素标记核酸探针荧光免疫反应图解
生物素和地高辛用缺口平移法或随机引物法进行标记,以用后者为多。氨乙酰荧光素,磺酸和汞的核苷酸探针标记利用简单的化学反应。产生荧光的物质各有不同,常用的有异硫氰酸荧光素(FITC),也有应用德克萨斯红(texaored)获得满意效果的。但藻红素(Phycoerythrin)应用效果较差,可能由于分子大的缘故。可同时应用AAF和生物素标记系统及汞与生物素系统分别应用不同的荧光素去标记两条DNA进行双重染色。
3.基本操作方法
(1)玻片准备:细胞用甲醇:醋酸(3:1)固定,滴在玻片上可保存在-20℃,如将此载片烘烤于65℃数小时,将会导致样品的人工老化。应用相差显微镜在低倍下定位最佳区域,或用嘴轻吹气的方法可以看见浮动的细胞。在玻片背面圈出盖片应覆盖的区域。
(2)RNA酶处理:加50μlRNA酶溶液,盖以盖玻片,放在湿盒内(2×SSC)37℃1h。应用2×SSC漂洗2×3min,室温,梯度酒精脱水(70%,90%,100%),在空气中干燥。
(3)蛋白酶K和多聚甲醛处理:对单个拷贝杂交,蛋白酶K溶液(0.3~0.6μg/ml,在20mmol/l Tris –HCl, pH7.5, 2mmol/L CaCl2)在37℃孵育2h。此法对甲醇-醋酸固定的淋巴细胞效果特佳,但这种浓度的蛋白酶K溶液对未事先经多聚甲醛固定的染色体制片可在靶DNA变性步骤中完全破坏。因此,需根据细胞类型调整溶液的浓度和孵育时间。蛋白酶K消化后,以2×SSC,在室温漂洗2min×3,再固定于4%多聚甲醛溶液中,室温10min。2×SSC洗2min×3。
(4)靶DNA变性:将载片浸入70℃变性溶液(70%甲酰胺,2×SSC)2min。新鲜的变性溶液需每周配制,贮存于4℃冰箱中备用。一张处于室温的载片放入50ml的染色缸(coplin jar)内,将会使溶液温度减低约1℃,因此,每次应加入少量玻片,以免影响溶液的温度致变性不完全。冷却变性处理后的载片可放在冰上或浸入70%酒精溶液1min。漂洗加震动以终止反应和彻底去除变性溶液。然后经梯度酒精脱水(80%,90%,100%),空气干燥。
(5)杂交液的准备
MM1 甲酰胺5.0ml
硫酸葡聚糖1.0g
20×SSC 1.0ml
(或50%硫酸葡聚糖)2.0ml
MM2 甲酰胺 5.5ml
硫酸葡聚糖1 .0gm
20×SSC 0.5ml
首先将溶液在70℃加温,以溶解硫酸葡聚糖,冷却后调整pH至7.0,容量加至70ml。这容量是最后应用的杂交混合液的70%,其余的30%为核酸探针和水(如果需要的话)。MM1给预杂交混合液是:50%甲酰胺,10%硫酸葡聚糖2×SSC。Trask发现MM2效果较MM1好,DNA的Tm比MM1低-8℃。在2×2cm区域杂交混合液应为:MM17μl,DNA探针(保存液为500μg~10mg/ml)1μl,加探针混合液2μl,总量为10μl。
(6)杂交:每张盖玻片加10μl杂交混合液,注意移除气泡,可在盖片四周加橡皮泥封固,在37℃湿盒中过夜。
(7)漂洗:从温箱中取出后,以镊子移除橡皮泥,从现在起注意勿使载片干燥。否则盐的晶体将产生非特异性背景染色,漂洗应用2×SSC(pH7)在45℃3min×3。不时震动以助彻底漂洗,盖玻片将在漂洗中自然移除。然后再在2×SSC,45℃,2min×3。保存载片于PBS溶液内。
(8)荧光显示:
①生物素标记DNA探针的荧光显示。
1)应用PBS含5%无脂干奶(5μl每张盖片),也可用1%牛血清白蛋白(BSA)-PBS覆盖孵育5min室温,以封闭非特异性结合部位。
2)移除多余液体,加抗生素-FITC(5μg/ml在PBS含5%奶粉或1%BSA,5μl/cm2)。在湿盒中,室温孵育20min。抗生物素-FITC在此应用是过量的,因此,可回收贮存4℃再次应用,其保存时间可达数周。反应见图20-4A直接法。
3)漂洗:PBs 2min×3,45℃。
4)如需放大(amplification),即提高其敏感度,可按图20-4B间接法加生物素化羊抗抗生物素抗血清(biotinylated goat – antivaidin antibody)30min室温。倾去加另一层抗生物素-FITC抗血清孵育20min,重复上述1)~3)。
②AAF标记核酸探针的荧光显示
1)封闭非特异性结合部位:从PBS中取出载片,吸干多余液体,加PBS-0.1%吐温(Tween)含2%正常羊血清(NGS)(5μl/每cm2盖玻片)。使载片停留在室温5min。2)倾去多余液体,加抗-AAF抗血清1:750,PBS-Tween –NGS溶液(如上i)5μl/cm2盖玻片。室温37℃。孵育30min.
3)漂洗:PBS-0.1%Tween室温5min×3,间歇性振荡。
4)羊抗小鼠IgG-FITC孵育,1:300~1:1000在PBS-0.1%Tween含2%NGS,37℃孵育30min,如3)应用PBS-0.1%Tween 漂洗5min×3。
4.荧光标记DNA探针在细胞核混悬液杂交中的应用
(1)细胞核的分离:将培养的细胞制成细胞混悬液,或以胰蛋白酶消化法于培养盖上收集培养细胞。应用MgSO4染色分离方法分离细胞核(Van den Engh et al 1986, 在Traok和Van Den Engh 34章 )。细胞混悬液浓度为5×106/ml。利用RNA酶消化后,使核从细胞分离,细胞核混悬液浓度为4~5×106细胞核/ml。
(2)细胞固定和酸的处理:在5ml试管内加冷的100%酒精不断旋转以达到满意的固定。在冰上停留10min。在4℃离心(×150g)10min。重复加三次冷的100%酒精入试管内,离心,倾去。置于冰上10min,再离心。然后加入相当核悬液1/2量的0.1n HCl , 0.5% Triton X-100。室温停留10min。加入IBM-0.25%Triton X-100(IBM配方:50mmol/l KCl, 10mmol/L MgSO4, 5mmol/L HEPES pH8.0)。再离心,重复IBM漂洗(这时细胞核可在不染色情况下,以荧光显微镜观察)后,以2×SSC-0.1%Tween漂洗1×3min,继之加入等量2%的多聚甲醛在1×PBS-5mmol/l MgSO4。在室温静置站立10min。倾去上清液,加IBm -Triton X-100漂洗,离心,使细胞核混悬液最终浓度为108/ml,(可用IBM-Triton X-100稀释约50倍,在血球计数器计数),混悬液镜检应含单个,完整的细胞核。
(3)细胞核混悬液杂交
①配制杂交混合液:甲酰胺5份,20×SSC1份,50%硫酸葡聚糖2份,pH调至7.0。此原液(stock solution)可贮存在4℃冰箱内。应用时加1份10mg/ml鲱鱼精子DNA(herring sperm DNA)。
②混合1μl的细胞核混悬液(108/ml)与18μl的杂交混合液,充分混匀。将此19μl混合液移入1.5ml容积的Eppendorf 管中(核含量约为105)。
③加入100ng/每管的AAF标记DNA探针(如为生物素标记DNA探针浓度为20~40ng/每管)。
④置70℃10min使DNA探针和核DNA变性。
⑤和组织切片与DNA探针杂交方法相较,不同的是在加热变性后切勿置冰上迅速冷却以终止反应,而应迅速转入37℃孵育过夜。
(4)杂交后漂洗
①在每管中加入1.25ml 50%甲酰胺-2×SSC(pH7.0),在42℃静置10~15min。偶尔旋转以助混匀。冷却至室温。加100μl经dimethylsuberimidate(DEMS)处理的血细胞(107/ml)混匀,离心,室温,10min,轻弹试管使沉淀的小块散开,加入1.25ml 2×SSC(pH7.0),42℃,继之,静置于室温10~15min,如前离心,再加1.25ml IBM-Triton X-100,室温静置5min,离心。
注:DEMS处理红细胞方法:经漂洗并离心去除白细胞和血清的红细胞在盐液如PBS中,细胞含量为108/ml,以K2CO3和DEMS溶液处理3次,第1次:K2CO3为20mmol/L,DEMS为3mmol/L,以后2次:K2CO3依然为20mmol/L,而DEMS为10mmol/L。在应用前将K2CO3和DEMS液混合加入红细胞混悬液中。在最后2次漂洗液中,应用100mmol/l K2CO3将pH调至9~10。在25℃,15min后,加入50μl,100mmol/l 的柠檬酸(citric acid)/每ml细胞混悬液的浓度以达固定红细胞的目的。固定的红细胞离心倾去上清液后,用2×SSC稀释到108/ml,加0.1%叠氮钠可在4℃保存至少1年。
(5)AFF标记的荧光显示:加200μl的PBS含0.05%Tween和2%正常血清(NGS),轻轻振荡混匀,室温静置10min,加20μl 1:100的单克隆抗AFF抗体,37℃孵育45min,加1.25ml的PBS-Tween,室温静置10min,加20间歇性振荡,离心,倾去上清液,加200μlPBS含0.05%Tween –2%NGS,振荡,室温静置10min,加20μl的羊抗小鼠–FITC荧光标记抗血清,稀释度1:100~1:300。孵育于37℃45min,加1.25ml PBS –Tween,室温静置10min,离心,倾去上清液。
(6)生物素标记探针的荧光显示:加200μl 4×SSC含0.1%Trion X-100 和5%BSA。室温静置10min后,加20μl抗生物素标记FITC抗血清15μg/ml,孵育在37℃30min,以1.5ml 4×SSc –0.1% Trion X-100洗1次,加入1.25ml IBm –Triton X-100,室温静置10~15min,间歇振荡、离心。
(7)荧光显微镜观察:将细胞核混悬液稀释于250μl的IBM-Trion X-100中,轻加振荡混匀。为抗荧光褪色可加等量的抗褪色溶液至载片上的细胞核涂片上,选择适当的激发波长观察。
(8)流式细胞计:将750μl的细胞核混悬液通过流式细胞仪(Flow cytometry, FCM),DEMS处理过的红细胞作为对照(Df 530/30nm, Omega ·Optical Inc, Brattleboro, VT)。详细操作见第十章 。
二、寡核苷酸探针的应用
寡核苷酸探针的优点在于它能根据需要人工用DNA合成仪合成,其长度及分子大小比较一致,可以控制。其长度一般较克隆的DNA片段短。目前,寡核苷酸探针已能成功的为放射性同位素、荧光素、生物素和地高辛所标记,并成功地运用于培养细胞、组织切片和染色体铺片等的原位杂交中。虽然有些科技工作者认为其敏感度不如来自质粒扩增的cRNA或DNA探针,但由于探针制备简便再加之于近年非放射性标记的成功,寡核苷酸探针在生物基础医学及临床学科领域中得到较为广泛的应用。
在原位杂交组织化学中应用寡核苷酸探针,其基本操作要点是相同的,如杂交温度在Tm -25℃,杂交孵育时间以过夜(16h左右)为佳。应用寡核苷酸探针在原位杂交组织化学技术中的成功与否主要决定于探针的设计,使有效配对率增加而错配(mismatch)减少。
(一)地高辛标记寡核苷酸探针的应用
1.组织处理
(1)冷冻切片:厚10~20μm,贴于事先经清洁处理及涂有粘附剂的切片上。切片保存于-80℃,在应用于杂交实验前,使迅速回升到室温,干燥,固定于3%多聚甲醛-PBS溶液中,pH7.4。PBS漂洗5min×3,孵育在2×SSc 10min。
(2)石蜡包埋切片:浸入二甲苯10min移除石蜡,以100%乙醇10min ×2,空气干燥10min,从高到低梯度乙醇(95%,80%,70%)1min/每个浓度。PBs 5min×3,孵育在2×SSc 10min。
(3)离心细胞涂片:将细胞先以4%多聚甲醛固定,应用离心沉淀法,将沉淀物涂于有粘附剂的载片上,应用PBS(含5mmol/l MgCl2)5min×3漂洗。在0.1mol/L三乙醇胺含0.25%(V/V)乙酸酐10min。在0.2mol/l Tris –HCl 含(0.1mol/L甘氨酸)pH7.410min。孵育在2×SSc 10min。
2.探针准备35pmol的寡核苷酸(oligo -)探针,3’ 终末标记以地高辛-11–dUTP。
3.预杂交和杂交加约300μl预杂交液(配制法见附录)在每张载片上,室温孵育1h。如为鲱鱼精子DNA,在应用前须在沸水浴中加热10min,而对酵母tRNA可不用加热变性。
(1)应用预杂交液稀释地高辛标记的Oligo-探针,探针理想工作浓度根据于待测核苷酸含量和实践的结果。如对于检测大鼠垂体的前促黑激素(proopiomelanocortin,POMC)mRNA的Oligo –探针,其理想工作浓度为342ng/ml(0.342ng/μl)。
(2)预杂交后以2×SSC漂洗,以吸水纸拭干切片周围水份,加30μl杂交液在切片上,加硅化盖玻片,在37℃过夜。如探针大于36碱基则杂交温度为42℃。次日室温2×SSC液漂洗切片1h,1×SSC漂洗切片1h(室温),0.5×SSc 37℃漂洗半小时,0.5×SSC室温漂洗半小时。
4.地高辛显示(同前)。
(二)同位素标记寡核苷酸探针的应用
1.组织处理大鼠应用1%戊巴比妥钠腹腔注射麻醉,经心脏灌注4%多聚甲醛-磷酸缓冲液中,约2h后(也可置于4℃冰箱过夜)取脑浸于同样固定液中加10%蔗糖溶液过夜,4℃。次日恒冷箱切片(-14℃),厚14μm左右,贴于有粘附剂的载片上,37℃或室温干燥以增加切片的粘附性。
2.杂交前处理同本章 第二节 放射性标记cRNA探针一节 。
3.杂交37℃过夜,余细胞同前。
4.杂交后漂洗2×SSc 5min×3,1×SSc 1min室温,0.5×SSc 55℃15min×2,室温漂洗于0.5×SSc 3min×2。梯度酒精脱水,切片室温干燥。
5.浸核乳胶切片浸入核乳胶,黑盒封闭,在4℃曝光2~3周(视同位素种类),显影,复染,观察。
(第二、三节 中所用试剂配制见附录)。