第十一章 免疫细胞化学在神经科学中的应用
免疫细胞化学的发展对许多领域的研究起到很大的推动作用,在神经科学的研究中尤为突出。本章 仅就免疫细胞化学在神经科学的基础研究方面的应用做一简要介绍。
一、确定神经递质的性质、定性和分布
早期的神经科学工作者应用传统的神经解剖学研究方法如甲基蓝染色法、镀银染色法等对中枢及外周神经系统的结构做了大量的研究工作,但由于技术方法的限制,对神经递质的性质无法确定。1949年Koelle建立了胆碱酯酶染色法(cholinesterase staining method, ChE)1964Rh ,Karnovsky 和Roots在此基础上改良并建立了一步完成的乙酰胆碱酯酶(Acetycholinesterase,AChE)直接染色法,使显示胆碱能神经成为可能。从生物测定来看,AchE和胆碱能神经的标志酶存在平行关系。因此,一般认为,在加用乙酰胆碱酯酶抑制剂的情况下,用Ache 显示胆碱能神经,仍不失为一种简便易行、可信的技术方法。但必须指出的是,一些接受胆碱能神经支配的细胞(称为胆碱能敏感细胞)和一些非神经细胞(如红细胞和骨骼肌)也可呈AchE阳性反应,甚至中枢神经系统内去甲肾上腺素(NA)能神经元集中的部位—蓝斑也呈现AchE阳性反应。因此,AchE阳性反应的不能就简单地确定为胆碱能神经元或神经。
50年代,Eranko就已发现用甲醛水溶液可使肾上腺髓质内含NA的神经细胞发生荧光。瑞典的Falck和Hillarp(1962)在此基础上改良并建立了用冷冻干燥和甲醛蒸汽诱发荧光,1974年Lindvall 和Bjorklund(1974)和de la Torre等(1976)相继建立和改良了乙醛酸诱发荧光法,开展了荧光组织化学的新篇章 ;为研究单胺类神经递质的定位和分布提供了手段。
70年代以来,免疫细胞化学技术的应用,使我们在对上述经典神经递质研究的基础上又迈进了一大步。与上述方法相比,免疫细胞化学技术具有较高的敏感性和特异性,例如应用胆碱能神经元的标志酶—胆碱乙酰移换酶(Choline acetylase, ChAc)的单克隆抗体就能较AChE法更准确地确定胆大能神经元,同样,应用多巴胺羟化酶(DβH)抗血清能较甲醛或乙醛酸诱发荧光法更为准确地研究NA神经元及其通路,而且不需借助显微分光光度计测定各种单胺递质呈现荧光的不同波长加以区别,免疫细胞化学应用不同的标志酶免疫染色就可区别各种神经元和/或确定神经元内所含的不同的神经递质。如DβH免疫反应阳性在哺乳动物即可做为NA能神经元的标志,因为哺乳动物不存在其它合成NA的酶,所有合成NA的部位均有DβH。酪氨酸羟化酶(TH)和多巴脱羧酶(DDC)阳性表示多巴胺(DA)能神经元系统,而TH,DDC,DβH和苯乙醇胺位甲基移酶(PNMT)免疫反应阳性即为肾上腺素(E)能神经元系统。
借助免疫细胞化学技术,至目前为止,还发现了有40种以上的神经肽分布于中枢神经、下丘脑、垂体、松果体、脊髓、神经节 及外周神经系统特定的神经元中。在脊椎动物,这些肽类物质在体内的分布呈多位性,不局限于神经组织或神经内分泌系统,如原先在脑或下丘脑、垂体中提取的神经肽如脑啡肽(ENK)、生长抑素(SOM)和血管活性肠肽(VIP)等也存在于消化道的内分泌细胞和壁内神经丛中,反之,一系列先从胃肠道分离的肽类激素如胆囊收缩素(CCK)、P物质(SP)等也在神经组织中发现,如CCK在人和猪大脑皮质含量非常丰富,达11nmol/每克脑组织,P物质在脑中30处以上的地方存在,这些多肽被称之为脑肠肽(brain gut peptides)。在外周器官如消化道、呼吸道中的肽类物质统称为调节 肽(regulatory peptide),包括存在于消化道与呼吸道等器官内分泌细胞内的多肽(在消化道又称胃肠激素)和存在于器官壁内神经丛中的神经肽。虽然神经肽,包括脑肠肽在机体中的确切生理作用还有待研究,是作为神经递质、神经调制物(neuromodulator )或神经激素(neurohormone)或二者兼而有之,还存在争论。但免疫细胞化学在神经科学中的应用已为我们开辟了一个新的研究领域,它确定在机体中除传统的胆碱能神经和肾上腺素能神经以外还存在第三上分枝—非肾上腺素能非胆碱能神经(non—adrener-gic non –cholinergic nerves, NANC)。Bloom等认为这第三种神经成分其末梢释放的递质是多肽类物质,又称肽能神经(Peptidergic nerves)。研究结果表明,机体全身的各个器官内都有不同种类和不同数量的肽能神经分布。在大鼠和丘脑下部、杏仁复合体,延脑内一些神经核和脊髓后角内均有较多的肽能神经元和纤维,小脑内仅有散在的肽能神经纤维,而大脑皮质内多数神经肽缺如,仅发现有CCK、SOM和VIP等数种。在消化道,存在一个壁内神经系统,Langley 称为胃肠神经系统(Enteric Nenvous System),现已发现其中含有VIP、SP、ENK、SOM等20余种神经肽,其它各脏器中也都有肽能神经分布。
二、探查和发现新的神经递质
免疫细胞化学可作为组织探针(Histological probe ),不断探查和发现新的神经递质。除上述的乙酰胆碱及其合成酶、肾上腺素及其合成酶、活性多肽以外,还可用以确定其它的疑义神经递质(Neurotransmitter chemical suspect)的性质和分布,包括5—HT及其有关酶类、γ—氨基丁酸(GABA)、甘氨酸、天门冬氨酸和牛磺酸等。
近年来,重组DNA工程与免疫细胞相结合而发展起来的原位杂交免疫细胞化学(In situhybridization Immunocytochemistry)作为组织探针,在发现神经系统特有的蛋白质和肽类方面。具有更高的特异性和灵敏性。重组DNA工程系列用制备的脑的多聚腺苷酸的mRNA,反转录为互补DNa (cDNA),克隆后与组织切片中的mRNA杂交,再按其cDNA核苷酸顺序推断出氨基酸顺序合成新的多肽,以此作为抗原,制备抗血清进行免疫细胞化学的研究,以发现新的神经肽。原位杂交免疫细胞化学技术,简言之,就是利用放射性同位素(或生物素)标记的cDNA片段与组织或细胞中特异的mRNA进行杂交来观察mRNA在体内的分布(详第二十章 )。发展这项技术,对发现神经系统特有的蛋白质或肽类,具有极大的潜力,如脑内特有的mRNA有30000种,目前已知的数10种神经肽仅占其中的一小部分。
三、追踪神经束的行径及其投射区
免疫细胞化学技术的引入,使神经解剖学追踪神经束的行径及其投射区的研究方法从单纯的采用损毁核团或压榨、切断神经不引起溃变,然后用镀银或其它染色法观察溃变的神经细胞体和末梢这一传统的技术中解脱出来。与70年代的HRP技术和放射性自显影术相比,免疫细胞化学技术不但能追踪神经束的行径及其投射区,而且可以定性,确定神经细胞核团或神经束所含神经递质的种类。量单纯用免疫组化染色在连续切片上追踪,常不能获满意结果,因为神经组织的多肽含量较低,在免疫组化染色的连续切片追踪过程中常有丢失的可能。故现在普遍采用的是免疫细胞化学技术与其它技术相结合的“杂交技术”,如与HRP、荧光物和放射自显影技术等相结合的逆行或顺行标记法、与AChe 和单胺荧光组织化学技术相结合的多重染色法等。Westlund1983年应用DβH抗血清注入脊髓,经轴浆运输到胞体,证明脑桥的NA能神经细胞群是脊髓内NA能神经纤维和终末的唯一来源。利用免疫荧光与荧光素进行标记相结合的方法,Mathy 和Hunt查清了过去一直了解得不太清楚的内脏感觉和味觉的传入径路,证明在内脏感觉和味觉由周围感受器传导至感觉皮质,中继部位在延髓的孤束核,脑桥的解剖学工作者还发现用麦胚凝集素(WGA)或霍乱毒素(Cholera Toxin)结合的HRP(CT—HRp ),在神经束行径追踪方面,较游离的HRP灵敏数10乃至100倍以上,因为结合的HRP是通过受体介导而被神经元摄入的。万选才等的研究工作表明CT-HRP较之单纯的HRP在显示树突终末状结构方面有很高的灵敏性。结合HRP的优点可归结为四点:①灵敏度高;②剂量低微;③充分、恒定地显示轴突、树突顺行(离胞体)标记;④降解时间长。以古老的切断神经或损毁神经细胞核团的研究方法与免疫细胞化学技术相结合以追踪神经细胞的起源仍在沿用,如Hokfelt在研究小肠SOM免疫反应性神经的来源时发现,切除肠系膜神经后,小肠SOM免疫反应性神经减少,而结扎肠系膜神经后DβH和SOM免疫反应物在结扎的神经近端聚集,说明小肠的DβH和SOM主要是通过肠系膜神经传运来肠壁的。也可采用化学神经阻断剂如6—羟多巴胺(6--OHDA)、红辣椒素(Capsaicin)等代替手术切断,与免疫细胞化学技术结合应用探寻神经束的行径和反射。
总之,免疫免疫化学技术的应用,使能在中枢较前更迅速、准确地显示了一些神经束的行径、神经细胞核团的定位和定性以及外周器官神经纤维的来源等。
四、区别神经细胞、神经胶质细胞和神经内分泌细胞
免疫细胞化学的发展进一步揭示了神经组织成分的特殊化学性质,利用这些特征不仅能区别神经细胞、神经胶质细胞和神经内分泌细胞,而且可进一步区分不同的神经胶质细胞。S—100是一种从脑组织提取出来的酶性蛋白,是钙结合蛋白的一种,它主要存在于神经胶质细胞、周围神经的雪旺氏细胞、交感神经节 中的卫星细胞和肠肌间神经丛的肠胶质细胞(Entericglial cell)。S—100 也可用于人类肿瘤组织发生的分类,如星形胶质细胞瘤、少突神经胶质细胞瘤雪旺氏细胞瘤显示S—100免疫反应阳性而脑膜瘤和髓母细胞瘤为阴性反应。神经元特异性烯醇化酶(Neuron-specific Enolase, NSE)是从脑组织分离出的一种酸性可溶性蛋白,是烯醇酶的同工酶之一。NSE是神经元特异性蛋白质,存在于神经细胞和APUD系统的神经内分泌细胞中,可作为神经元和神经内分泌细胞的标志酶,在星形胶质细胞瘤、脑室管膜瘤、少突胶质细胞瘤、脑膜瘤和雪旺氏细胞瘤中,NSE呈免疫反应阴性,而神经母细胞瘤为NSe 免疫反应阳性。皮肤的Marker细胞,细胞学分类归属不明,经NSE免疫染色反应呈阳性结果,结合电镜观察证明在该类细胞中含有致密核心的大囊泡,属APUD系统的神经内分泌细胞。在APUD系统的其它细胞如垂体前叶中肽类细胞、肾上腺髓质细胞等以及APUD瘤中,NSE均呈阳性反应。NSE又是神经元分化的标志酶,可以用以研究体内、外神经元的分化发育过程。
近来,免疫细胞化学工作者又利用各种细胞中所含中间丝提纯制成特异性的单克隆抗体血清用于细胞学归属和病理学的检测。这些中间丝包括:①上皮细胞或上皮源细胞中的前角质蛋白(Prekeratin)或称细胞角质蛋白(cytokeratin);②心肌、平滑肌或骨骼肌细胞中的结蛋白(Desmin);③间质细胞或间充质细胞中的波形微丝(Vimentin);④神经胶质细胞中的胶质纤维酸性蛋白(Glial Fibrillory Acidic Protein, GFAP);⑤神经细胞中的神经微丝(Neurofilament, NF)等(详见第十二章 )。实验证明,GFAP是星形胶质细胞特异性标志蛋白,具有星形胶质细胞分化潜能的肿瘤如髓母细胞瘤也含有GFAP,而少突胶质细胞和小胶质细胞呈阴性反应。肠道肌间神经丝内胶质细胞原来细胞学分类归类不明,经GFAP染色呈阳性反应,说明其中与中枢星形胶质细胞属于同一细胞学范畴。O1—O4抗原和半乳糖脑苷脂(Galactocerebroside)只存在于少突胶质细胞,griffonia simplicifloia凝集素仅对小胶质细胞呈阳性反应(小胶质细胞膜上有2—d –半乳糖)。据此,可区分不同类型的神经胶质细胞。
总之,免疫细胞化学技术的发展,解决了过去依赖Nissl 、Cajal和Golgi等传统的神经组织染色法所不能完全解决的问题。进一步揭示了神经细胞的特殊化学性质,现在神经组织内已证实的物质包括蛋白质、肽类、酶类、神经递质和胺等不下50余种,其中神经系统的特异性蛋白质有20余种,与神经元有关的除NSE外,还有神经微丝蛋白,微管蛋白,碱性蛋白(只存在于大脑神经元内的一种组蛋白)和只存在于嗅球神经元中的嗅球蛋白等;与神经胶质有关的有:神经收缩蛋白、小泡蛋白、突触蛋白(Synaptin)、GP350和D1、D2、D3等,为进一步研究神经细胞、神经胶质细胞、神经内分泌细胞及其结构成分提供了有力的手段。
五、研究神经递质的超微结构定位
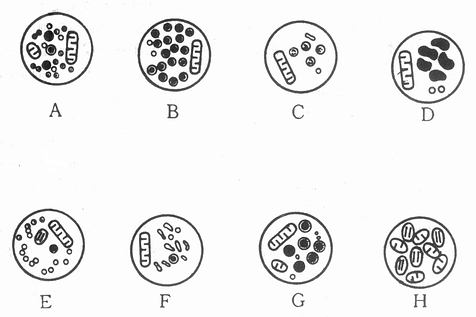
应用免疫电子显微镜技术(常用为PAP法或胶体金标记技术)可显示抗原在神经细胞内的超微结构定位及在突触水平神经元间的联系的化学本质。Pickel应用免疫电镜观察证明TH存在于DA和DA能神经元的细胞体、树突和近侧轴突。在胞体内此酶定位于内质网、Golgi器和微管上。神经终末枝的突触小泡一般认为是神经递质的亚细胞贮存部位,在电镜下观察神经末梢内突触小泡呈现不同形态,目前已有文献报道的近10余种,比较常见的为无颗粒小泡型(Small agranular vesicles , SAV)或称清亮小泡型(Small Clear Vesicles, SCV),其直径50~90nm,中心无颗粒(图11-1E);该型常混有不同比例含致密核心的大囊泡,直径80~150nm。其次是颗粒小囊泡型(Small granular vesicles, SGV),直径45~70nm,内含有电子密度高的致密核心(图11-1A)。第三是大颗粒泡型(large granular vesicles, LGV),直径80~160nm的突触小泡内含有电子密度高的致密核心(图11-1B)。其它还有扁平囊泡型、线粒体型等(图11-1)。是否不同形态的突触小泡代表了含有不同种类的神经递质尚有争论。有学者认为不同形态的突触小泡只是使用不同种类固定液的人工假象,然而越来越多的实验证明表明,固定液的种类固然有一定影响,但神经终末突触小泡的形态和内含递质的种类似乎存在一定的相关性,SAV型是取得比较一致意见的神经终末类型,它和骨骼肌运动终板(也是神经—肌肉的突触)内所含突触小泡的形态相一致,后者已证明为乙酰胆碱神经递质的贮存处,细胞化学示Ach阳性反应,电刺激时突触小泡减少,示释放现象。这种类型的突触小泡内可能含有乙酰胆碱。

图11-1 神经末梢突触中囊泡类型
SGV型一般认为是单胺介质的贮存部位,单胺类介质。包括儿茶酚胺和吲胺二种,属于前者的介质有去甲肾上腺素、多巴胺、肾上腺素、属于后者的介质为5—HT。在常规电镜生物样品处理的过程中,小颗粒囊泡不易显示,须应用0.1mol/L磷酸盐缓冲液(pH7.0)配制的3%高锰酸钾溶液(Richardson1966)或铬酸盐/重铬酸盐溶液(Tranzer 1976)固定,方能获得满意结果。认为SGV是单胺递质贮存部位的根据是:用利血平注射能使小泡内致密核心消失,而用伪介质(Pseudo—neurotransmitter )如5-羟多巴胺(5—OHDA )注射动物,由于伪介质能置换内源性单胺而被吸收和贮存于突触囊泡中,末梢中小颗粒囊泡的数目增加,电刺激交感神经可使小颗粒囊泡减少,而将α甲基去甲肾上腺素给予被拟交感神经药物或被电刺激耗竭了介质的动物,其神经末梢中的小颗粒囊泡又可重新出现。但1982年Wilson等应用多种实验证明,至少在小肠肌间神经丛内,肾上腺素能神经的终末支是扁平无颗粒囊泡型(flat agranular vesicles, FAV),而不是SGV型。1965年Taxi在两栖类动物的肠道中发现含大颗粒囊泡的神经终末支LGV,Baumgarten(1970)在哺乳动物肠道也发现了LGV型神经终末支,因其形态与丘脑下部含肽的神经末支相似,故命名为P型神经终末支,意即肽能神经(Peptidergic nerves)终末支,而有作者认为凡是颗粒囊泡,包括SGV和LGV都是单胺类递质的贮存部位。免疫电镜技术部分地解决了这一争论。应用PAP和胶体金免疫电镜技术证明VIP、SP、降钙基团相关肽(CGRP)和神经肽Y(NPY)等多肽类物质确实定位于大颗粒囊泡中(Larsson 1976, Bishop 1982, Probert et al, 1983)。有作者还认为不同种类的多肽分别被包含于不同直径的大颗粒囊泡中,如SP定位于直径85nm的大颗粒囊泡中;VIP:囊泡直径98nm;ENK:囊泡直径110nm等,但不同作者在不同动物种属和不同组织、应用方法不同报告结果各异,难以结论。Fried(1985)应用免疫组化、电镜技术和密度梯度离心法相结合,证明在大鼠输精管神经终末支小颗粒囊泡中含有NA,而大颗粒囊泡分为三种类型:单纯含NPY或NA,或NA与NPY共存于一个囊泡中。Burnstock还提出直径100~200nm的大的不透明囊泡(LOV型)系嘌呤能神经递质的贮存部位(图11-1,G),神经终末支内全为线粒体所充满的可能属感觉神经终末支(图11-1,H)。凡此种种,都说明虽然免疫电镜提供了神经递质超微结构水平定位定性的可能,但神经终末内突触小泡的形态与神经递质种类之间的关系始终还有待于进一步的研究。如SAV型在外周可能是代表胆碱能神经的终末支,在中枢能否说SAV内所含的都是乙酰胆碱,其它各型的突触小泡内所含神经递质的种类也还需要进一步研究。在技术方法上的运用,根据笔者体会,应用免疫电镜PAP法,免疫反应复合物相当大,有时很难准确地判断免疫反应复合物的定位,因在囊泡基质内和囊泡膜上雹有反应物附着,免疫胶体金电镜技术避免了上述缺点,胶体金颗粒的沉积比较集中于囊泡基质内,在递质超微结构定位的研究上似较PAP法优越。
六、神经递质共存的研究
免疫细胞化学在神经科学的运用打破了传统的一个神经细胞只产生和释放一种神经递质的概念。在中枢和周围神经系统,近年来,有较多的实验报告证明在一个神经细胞内存在两种或两种以上的递质,这种递质共存不是偶然和个别的现象,而是一种带普遍规律的问题。在光镜水平显示神经细胞内两种抗原的共存,其分辨率只限于胞体,观察神经纤维内两种抗原的共存,必须借助免疫电镜技术。共存情况可出现于:(1)经典神经递质间,如在大鼠颈上交感神经节 的相邻照片上,同一神经细胞分别显示NA和ACh阳性;(2)经典递质与单胺类递质间,如在松果体交感神经末梢中,不仅含有NA,而且含有5—HT;(3)经典递质和神经肽间,如在大鼠的椎前神经节 中,大约有60%的NA能神经细胞同时显示SOM免疫反应阳性,说明SOM与NA的共存,在交感神经系统中NPY与NA的共存,在副交感神经系统中VIP与ACh的共存,已得到较为普遍的证实;(4)单胺类递质与神经肽的共存,如大鼠输精管的交感神经终末支中NA与NPY的共存,在豚鼠肠道肌间神经节 中5—HT与SP免疫反应物共存一个神经细胞内,和(5)神经肽间的共存,如SP与CGRP常共存于感觉神经终末支,Gibbins等(1987)在豚鼠背根神经节 细胞中证明SP、CGRP、CCK和强啡肽(Dynorphin,DYN)四种神经肽的共存。对于神经递质共存的亚细胞部位,Hokfelt曾对肽和胺的共存提出了一种假说,即:①它们可分别贮存于同一神经终末内的不同形态的突触小泡内;②共存于大颗粒囊泡和小颗粒囊泡内;③仅共存于小颗粒囊泡中;④仅共存于大颗粒囊泡内;此假说尚待进一步证实。Fried 的实验结果表明,在大鼠输精管,胺和肽的共存仅发生于大颗粒囊泡内,Andrzejloesch 和Burnstock实验证明在豚鼠肠道肌间神经丛内VIP和ACh共存于SAV小囊泡内。应用胶体金免疫电镜技术,以不同直径的金粒标记不同的抗原,是研究递质共存的超微结构定位较为理想的手段。
关于递质共存的生理意义,目前还不十分清楚,有作者设想与经典递质共存的肽类可作为辅递质,在神经细胞释放时,对突触后膜上主递质的受体起调制作用,从而调制信息传递。Hokfelt(1980)提出两种递质共存的生理意义有以下五种可能性:①两种递质可穿过突触间隙作用于突触后细胞,作用于相同或不同的受体;②一种物质激活突触后细胞的受体,另一种物质则封闭另一种类型的受体,如在5—HT和SP共存的情况下,5—HT直接抑制突触后细胞,SP封闭其它末梢释放的ACh对突触后的细胞的兴奋作用;③一种物质作用于突触后细胞,第二种物质则作用于突触前末梢的自身受体(autoreceptor),从而调制细胞终末对神经递质的释放;④一种物质作用于突触后细胞,第二种物质则作用于其它末梢上的突触前受体;⑤一种物质作用于一类细胞,另一种物质作用于另一种细胞,在这方面典型的例子是汗腺,汗腺的交感神经元内含有VIP和ACh,前者作用于周围小血管,增加血流量;后者作用于腺体,刺激汗腺分泌。
总之,递质共存的研究是神经科学领域中一个崭新的课题,它的研究对进一步了解复杂的神经系统的结构和功能有重要意义,而在这项课题的研究中,免疫细胞化学(包括光镜和电镜)无疑是一项有力的工具。
七、个体和种族发育的研究
神经系统是一个历史发展的产物,有种族发育和个体发育的历史。在种系发生方面,有不同的发育规律,如一些神经肽自腔肠动物已经发生,而VIP自鱼类才开始发生。免疫反应的强弱和神经肽的含量亦因种属不同而异,如笔者对输精管的神经支配的研究表明,在大鼠、豚鼠和猫等动物,输精管管壁内有丰富的神经分布,而在人输精管神经分布异常稀疏。研究神经肽的发生可以帮助了解肽类的发生规律,有利于选择和建立实验动物模型。个体发育,不但指胚胎发育,也指动物出生后发育以至衰老的规律,神经系统的任何一个部分都可以从发育的角度去研究。在肠道,Epstein等在鸡小肠壁内神经丛的研究表明,在鸡胚发育的第7日出现胆碱能神经成分,5~7天出现5—Ht 神经细胞,NA神经终末出现于第12~16日,神经肽出现在这些递质之后。在小鼠、豚鼠和兔小肠壁内神经从发育规律的研究报告和鸡相似。神经肽的出现较晚,而神经对肌肉发育的作用更晚,如在豚鼠小肠,虽然在胚胎第25日出现了胆碱能神经细胞,但肌肉对神经的反应性出现在胚胎的第48日。各种神经肽的含量和含肽类神经细胞的数目都随发育、成长、衰老而产生规律性变化,如大鼠全脑或脑各分区中NSE的含量随发育而增高,在第13天胚胎时NSE含量为50ng/mg蛋白质,到成体(第40日)时为11000ng/mg蛋白质,而定位于神经胶质的非神经无烯醇酶(No-neuronal enolase, NNE),在第11日的胚胎为8500ng/mg蛋白质,出生后下降至5000ng/mg蛋白质,到成体(第60日)时为11000ng/mg蛋白质。以上结果表明,随着神经细胞的产生,NSE增加,而NSE/NNE比例显著增高,说明在大鼠脑神经元的分化过程中可能存在着由NNE转变为NSE的生物化学分子变化。杨恬、蔡文琴等(1994)报告了六种肽能神经在人胚胎期的发育规律,AChE神经出现最早,其它肽能神经出现时间不一,分别在第11~16周。同一个体不同器官肽能神经并非同时发生,如膀胱肽能神经出现较小肠为晚。总之,神经系统种族发育和个体发育这个领域的研究还有待于进一步发掘。
八、与神经组织培养技术相结合进行神经生物科学的研究
神经组织培养是从机体中取出组织或细胞,在模拟机体内生理条件下进行体外培养。免疫细胞化学技术可用于培养的单个细胞或组织片染色,单个细胞可直接固定或冰冻后进行免疫染色,而组织片在固定或冰冻后常需进行切片后染色。由于体外神经组织培养技术能使复杂的神经系统简单化,换而言之,能在神经系统的结构与功能的研究方面提供一个简单的模型,近年来,随着培养技术的发展和与其它科学的相互结合,在神经生物学这一研究领域中提供了不少的新资料,如利用免疫细胞化学技术可对原代分离培养的神经细胞和神经胶质细胞进行细胞的特异抗原标记(可以是细胞表面或细胞质内成分),从而区别其细胞类型,如用GFAP标记星形胶质细胞、半乳糖脑苷脂、髓磷脂碱基蛋白(myelin basic protein, MBP)标记少突胶质细胞、NSE标记神经细胞、Ran-α标记胶质细胞表面的抗原等,这些特异的标记在神经生物学和临床科研中有很大潜能,细胞表面标记能够区别活细胞,精确地研究细胞间特性和相互作用,细胞内标记能有助于对神经细胞结构、功能及相互作用的研究。Mirsky及其同事们利用半乳糖脑苷脂(GC)、硫脂(Sulphatide, S)和MBP对培养的雪旺氏神经胶质细胞和少突胶质细胞的研究表明,雪旺氏神经胶质细胞在与其所依附的轴突分离后不超过5~6天,GC、S和MBP的免疫染色均为阴性,表明雪旺氏细胞需要持续性地从相应的轴索获得信息(Signal)才能制造出可为免疫染色所检测出的髓鞘特异性糖脂和蛋白,而少突胶质细胞则否,在没有神经细胞存在的情况下培养数周,仍保持GC、S和MBP免疫反应阳性。本实验结果成功地证明少突胶质细胞和雪旺氏神经胶质细胞产生髓鞘的方式是不同的。Abney等利用培养的胚胎和新生大鼠的脑细胞混悬液进行特异性免疫标记染色,证实了不同类型细胞在脑内的发育顺序:破伤风毒素阳性神经细胞出现在第10天的胚鼠脑(测试的最早时间),GFAP阳性星状胶质细胞出现在15~16天的胚脑,而GC阳性少突胶质细胞直至出生后2~3天方才出现。利用18天胚鼠的小肠壁内神经丛培养后进行各种神经肽的免疫染色,Schultzberg等发现在这时的小肠壁内神经丛已具有内源性的VIP、SP、ENK和SOM免疫反应性神经元。
九、应用于受体的研究
由于免疫细胞化学所应用的各种标记物如铁蛋白、胶体金和荧光素等都能无例外地与配体(即与受体呈特异结合的物质)相结合,因此可应用于细胞表面(包括神经细胞和神经胶质细胞)表面受体的定位。Philips和Bennet(1987)应用抗肌球蛋白和荧光素标记的α-眼镜蛇毒素成功地显示了乙酰胆碱受体(Acetycholine receptor clusters)在鸟肌上的发育规律。近年来,应用免疫细胞化学技术进行受体再循环的免疫电镜观察,取得了令人瞩目的进展。Geueze利用胶体金-蛋白A-抗唾液酸糖蛋白的受体抗体在免疫电镜下观察证明,配体与细胞表面的相应受体结合后,由受体介导入肠作用而进入胞内,在入胞早期,唾液腺糖蛋白及其受体均存在于有覆衣囊泡中,并与囊泡内表面密切结合。在人胞囊泡内,则见配体游离于囊泡腔中,内移的受体可再循环回细胞表面加以利用。本实验结果为细胞膜受体的再循环提供了有力的证据。
十、神经系统的机能研究
免疫细胞化学在神经科学的应用已由单纯的形态学研究逐步向与机能研究、应用研究和临床实践相结合。如研究脑啡肽与镇痛的关系,SP与转导伤害性刺激的关系以及在各种生理和病理条件下神经肽的变化与病理生理作用机制的关系等。在研究方法上也不断改进,如免疫组化的定量研究由简单的积分法逐步走向与放射免疫测定相结合、与图像分析相结合,测定单位面积内和/或每个神经细胞内免疫反应物含量的变化。
参考文献
1.Abney ER, et al. Astrocytes ependymal cells and oilgodendrocytes develop on schedule in dissociated cell cultures of embryonic rat brain. Dev Biol, 1981;83:301
2.Andrzejloesch and Burnstock G. Ultrasturctural identification of VIP-containing never fibres in the myenteric plexus of the rat ileum. J Neurocytol, 1985;14:327
3.Baumgarten HG. et al. Auerbach’s plexus of mammal and man:electron microscopic identification of three types of neuronal processes in myenteric ganglia of the large intestine from rhesus mondeys, guineapigs and man. Z Zellforsch, 1970;106:376
4.Bishop AE, et al. Peptidergic nerves. (Basic Science in Gastroenterology, Structure of the Gut, Eds Polak JM, Bloom SR, Wright NA and Daly, MI) , PP ,221 Were Herst. UK Glaxo Group Research Limited, 1982
5.Cook RD and Burnstock G. The ultrastructure of Auerbach’s plexus in the guinea-pig. I. Neuronal elements. J Neurocytol , 1976;5:171
6.Epstein LM, et al. Deyelopment of serotonergic neurons in the chick duodenum. Devel Biol, 1980;77:22
7.Fried G, et al. Evidence for differential localization of noradrenaline and neuropeptide Y in neuronal storage vesicles isolated from rat vas deferens. The J Neuroscience, 1985;5(2):450
8.Hokfelt T, et al. In :Neural peptides and Neuronal communications, Eds:Costa E and Trabucchi M. PP. 1~23, 1980
9.Karnovsdy MJ and Roots L. A “direct-colouring”thiocholine method for cholinesterase. J Histochem CYtochem, 1964;12:219
10. Lindvall O and Bjorklund A. The glyoylic acid fluorescence histochemical method :a detailed account on the methodology for the visualization of central catecholamine neurons. Histochemistry, 1974;39:2>7
11. Larsson LI, et al. Localization of vasoactive intestinal polyptide (VIP) to central and peripheral neurons. Proc of the National Academy of Sciences USA, 1976;78:3197
12. Larsson LI, et al. Occurence of vasoactive intestinal polypeptide (VIP)-like immunoactivity in certain cholinergic neurons of the cat:evi-dence from combined immunocytochemistry and acetylcholinesterase stainin.Neuroscience, 1979;4:1539
13.Mantyh P and Hunt SP. Neuropeptides are present in projection neurons at all levels in visceral and taste pathways;from periphery sensory to cortex. Brain Ros, 1984;299:297
14. Marangos PJ, et al. Developmental profile of neuronspecific (NSE)and non-neuronal enolase (NNE). Brain REs. 1980;190:185
15. Mirsky R et al. Myelin –Specific proteins and glyclipids in rat Schwann cells and oligodendrocytes in culture, J Cell Biol,1980;84:483
16. Probert L, et al. Ultrasturctural localization of four different neuropeptides within separate populations of P-type nerves in the guinea-pig colon. Gastroenterology, 1983;85:1094
17. Polak JM and Bloom SR. Regulatory peptides of the gastrointestinal and respiratory tracts. Arch Int Pharmacol, 1986;280(suppl):16
18. Schwartz JP and Costa E,Hybridization approaches to the study of neuropeptides. Ann Rev Neurosci, 1986;9:277
19. Sterit WJ and Krewtzberg W. Lectin bining by resting and reactive microglia. Neurocytol, 1987;16:249
20.朱长庚.免疫细胞化学在神经科学研究中的应用.解剖学杂志,1986;9(1):68
21. 杨恬蔡文琴.人胚胎期小肠六种肽能神经发生的研究.解剖学报.1994(25):84
22.韩济生,主编.神经科学纲要.北京医科大学、北京协和医科大学联合出版社,1993
(蔡文琴)