
第二节 基因治疗 Gene Therapy
许多疾病如遗传性疾病、肿瘤等与人体的基因异常有密切的因果关系。早在DNA重组技术之前就有人提出将正常基因顺序导入病人体内进行基因水平治疗的设想。Edward Tatum 和Joshua Lederberg 在60年低曾提出可利用病毒作为基因转移的载体。但直到1990年才成功地实现了用基因治疗手段尝试治疗腺苷酸脱氨酶缺乏症(adenosine deaminase deficiency)。到目前为止,已报道的基因治疗方案已超过百种。有300多病人接受了这种新的治疗方式。基因治疗的对象不再局限于遗传病,而被扩展到肿瘤和传染病等多种疾病。其发展相当迅速,前景十分看好,我国学者也在用基因治疗方式治疗血友病方面做了一定工作。目前已积累了一定的经验和教训,有了一些可遵循的操作程序及可供选择的治疗方式。但这种新的治疗方式仍有许多环节需要不断改进和提高。
一、基因治疗的概念和策略
基因治疗(gene therapy)就是用正常或野生型(wild type)基因较正或置换致病基因的一种治疗方法。在这种治疗方法中,目的基因被导入到靶细胞(target cells)内,他们或与宿主细胞(host cell)染色体整合成为宿主遗传物质的一部分,或不与染色体整合而位于染色体外,但都能在细胞中得到表达,起到治疗疾病的作用。
目前基因治疗的概念了较大的扩展,凡是采用分子生物学的方法和原理,在核酸水平上开展的疾病治疗方法都可称为基因治疗。随着对疾病本质的深入了解和新的分子生物学方法的不断涌现,基因治疗方法有了较大的发展。根据所采用的方法不同,基因治疗的策略大致可分为以下几种:
基因置换(gene replacement):基因置换就是用正常的基因原位替换病变细胞内的致病基因,使细胞内的DNA完全恢复正常状态。这种治疗方法最为理想,但目前由于技术原因尚难达到。
基因修复(gene correction):基因修复是指将致病基因的突变碱基序列纠正,而正常部分予以保留。这种基因治疗方式最后也能使致病基因得到完全恢复,操作上要求高,实践中有一定难度。
基因修饰(gene augmentation)又称基因增补,将目的基因导入病变细胞或其它细胞,目的基因的表达产物能修饰缺陷细胞的功能或使原有的某些功能得以加强。在这种治疗方法中,缺陷基因仍然存在于细胞内,目前基因治疗多采用这种方式。如将组织型纤溶酶原激活剂的基因导入血管内皮细胞并得以表达后,防止经皮冠状动脉成形术诱发的血检形成。
基因失活(gene inactivation):利用反义技术能特异地封闭基因表达特性,抑制一些有害基因的表达,已达到治疗疾病的目的。如利用反义RNA、核酶或肽核酸等抑制一些癌基因的表达,抑制肿瘤细胞的增殖,诱导肿瘤细胞的分化。用此技术还可封闭肿瘤细胞的耐药基因的表达,增加化疗效果。
免疫调节(immune adjustment):将抗体、抗原或细胞因子的基因导入疾人体内,改变病人免疫状态,达到预防和治疗疾病的目的。如将白细胞介素-2导入肿瘤病人体内,提高病人IL-2的水平,激活体内免疫系统的抗肿瘤活性,达到防治肿瘤复发的目的。
其它:增加肿瘤细胞对放疗或化疗的敏感性:采用给予前体药物的方法减少化疗药物对正常细胞的损用力。如向肿瘤细胞中导入单纯疱疹病毒胸苷激酶基因,然后给予病人无毒性GCV药物,由于只有含HSV-TK基因的细胞才能将CGV转化成有毒的药物。因而肿瘤细胞被杀死,而对正常细胞无影响。
总之,基因治疗的策略较多,不同的方法在实践中各具有优缺点。而基因的治疗本身也并不局限于遗传病的治疗,现已扩展到肿瘤、病毒性疾病等。基因治疗可用于疾病的治疗,也可用于疾病的预防。应该指出的是基因治疗并不是万能的,尚不能取代现有的治疗方法,作为一种新的方法也还有一些需进一步完善的地方,在实践是应相互结合,取长补短,以取得较好的治疗效果。
一些常见疾病的治疗策略见表1。
表23-1 基因治疗策略
| 遗传性疾病 |
| --隐性遗传病
--用正常基因置换致病基因而达到完全校正 --导入正常基因序列以达到暂时性校正 --显性遗传病 --用正常基因置换致病基因而达到完全校正 --使有害基因失活而达到暂时性校正(如用反义技术、核酶等) --在某些情况下可导入正常基因加以校正(如LDL受体) |
| 肿瘤 |
| --杀伤肿瘤细胞(如利用自杀基因,激活免疫系统及保护正常细胞免受化疗药物的损伤等)
--使癌基因失活(反义技术、核酶)或增加抑癌基因的表达 |
| 伟染病 |
| --杀伤传染源(免疫法、自杀基因)
--使传染源失活(反义技术、核酶、核酸陷井) |
| 其它疾病 |
| --导入药物基因(药物释放)如激素、细胞因子
--失活有害基因产物(反义技术、核酶、核酸陷井) --杀伤策略如减少特异细胞群 |
二、基因治疗的基本程序
基因治疗是在基因工程基础上发展起来的分子生物学技术,它相对于现有其它治疗方法较为复杂。基因治疗的基本过程包括以下主要方面:
(一)目的基因的选择和制备
基因治疗的首要问题是选择用于治疗疾病的目的基因。对遗传病而言只要已经研究清楚某种疾病的发生是由于某个基因的异常所引起的,其野生型基因就可被用于基因治疗,如用ADA基因治疗ADA缺陷病。但在现在的条件下,仅此是不够的。可用于基因治疗的基因需满足以下几点:在体内仅有少量的表达就可显著改善症状;该基因的过高表达不会对机体造成危害。很显然某些激素类基因如与血糖浓度相关的胰岛素基因目前尚不能用于糖尿病的基因治疗。在抗病毒和病原体的基因治疗中。所选择的靶基因应在病毒和病原体的生活史和起重要的作用并且该序列是特异的,如针对HBV的HBeAg或X基因等。肿瘤病人多有免疫缺陷,可选用免疫因子基因转入人体,肿瘤细胞内往往存在多种基因异常形式,可采用反义技术封闭细胞内活化的癌基因或向细胞内转入野生型抑癌基因,抑制肿瘤生簪,所针对的癌基因或抑癌基因应下该肿瘤的发生和发展有明确的相关性。
在确定欲选目的基因后,就在制备目的基因。正向表达的基因可以是cDNA(complementary DNA),也可是基因组DNA(genomic DNA)片段。可用传统的方法获取,也可采用多聚酶链式反应(polymerase chain reaction PCR)等新技术进行体外扩增。部分反义基因也可采用此法获得,但多数情况下采用人工合成的方式制备。
(二)基因的转运
目前已有多种基因转运的方式,其基本原则是将外源基因运到细胞内。已使用的有病毒载体和非病毒载体两大类。
病毒载体:病毒具有一些独特的性质如多数病毒可感染特异的细胞,在细胞内不易降解;RNA病毒能整合到染色体以及基因水平较高等。因此病毒载体是良好的基因转运载体。目前已被用作载体的病毒有逆转录病毒、腺病毒、腺相关的病毒。疱疹病毒和肝炎病毒等。逆转录病毒用作载体时需进行几步改造:(1)将天然的野生型RNA前病毒转变成DNA载体,并插入欲转移的相关外源基因。其基本原则是用标记基因和外源基因替代病毒的编码基因,如图23-2所示。(2)制备辅助细胞为载体DNA提供其丧失的功能,如图23-3所示。(3)将载体DNA导入辅助以产生病毒载体。如图23-4。(4)病毒载体感染靶细胞,外源基因在细胞内得以表达,如图23-5所示。
STEP 1
INSERTING FOREIGN DNA INTO THE RETROVIRAL PROVIRUS
Wild-Type Provirus

图23-2 Scientists use recombinant DNA techniques to replace the gag,pol,and env genes with one or more foreign genes.The foreign genes can be inserted in several different patterns.in this example,a selectable marker gene(neo)replaces the viral gag and pol genes and a human gene replaces the env gene.
STEP 2
MAKING THE HELPER CELL
Desiging the Helper Vius
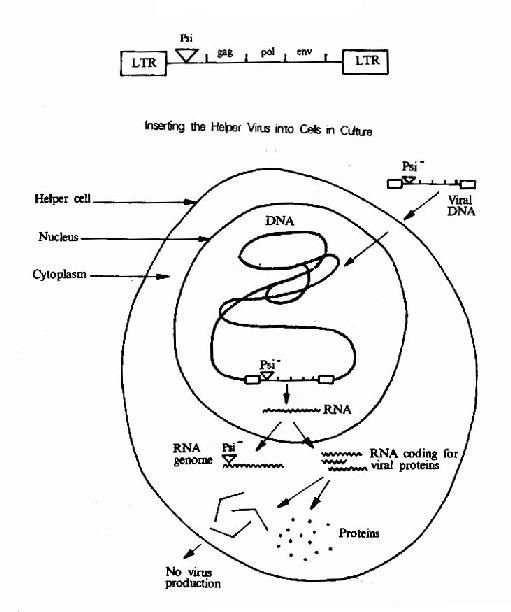
图 23-3 The helper cell should meet two basic requirements:(1)it should provide functions missing from the the vector virus,and(2)it should not be capable of producing viable virus particles. The crucial element in the development of a successful helper cell is the design of the helper virus.Researchers use recombinant DNA techniques to disable the helper virus in the test tube-one of the most common measures is removal of the Psi fragment.The Psi-deficient helper virus produces all of the normal viral proteins, but cannot package its own RNA because it lacks the appropriate packaging signal. Helper virus DNA is inserted into the genome of the helper cell using chemical techniques.
STEP 3
PRODUCING THE VECTOR
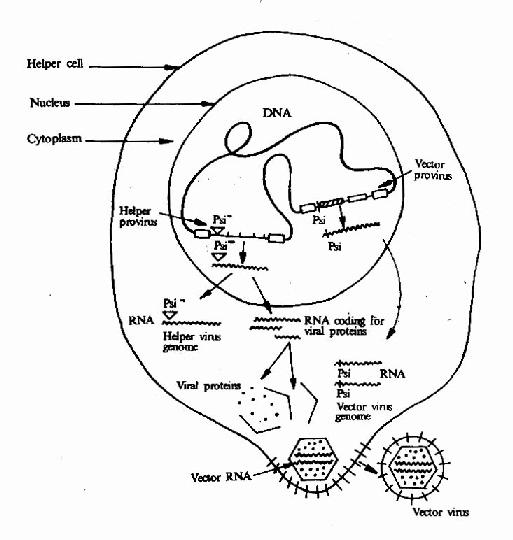
图23-4 Scientists use chemical measures or an infection technique to insert recombinant vector DNA (including a human gene) into helper cells.Because the vector provirus contains the Psi sequence, the vector RNA genome is automatically encapsulated by viral proteins produced by helper virus DNA in the helper cell. The resulting viral particles are released by budding from the helper cell membrane. The vector virus is capable of only one infection because it lacks the information needed to make viral proteins.
STEP 4
INFECTING THE TARGET ELL
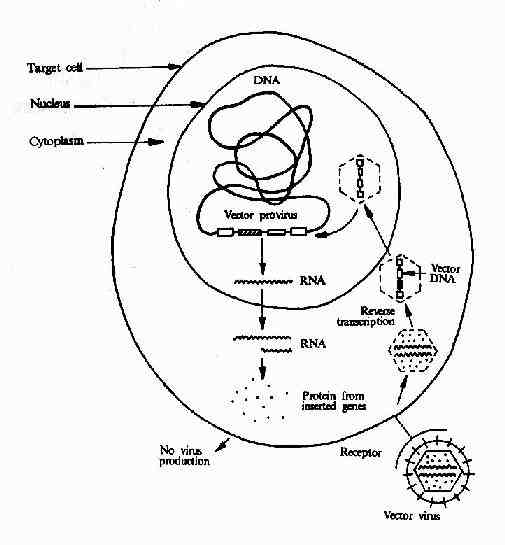
图23-5 Researchers infect target cells (such as human bone marrow cells)with the vector virus in two different ways: they mix them with helper cells producing the virus, or they bathe them in fluid harvested from the helper cell culture.When the vector provirus is integrated into the target cell DNA ,enzymes from the target cell treat it as an integral part of the genome. Cellular enzymes do the work necessary to make proteins from the foreign genes located between the two viral L TRs.
非病毒载体:这类载体的发展较快,目前主要是脂质体,一些具有受体功能的载体也呈现出诱人的前景,关于常见载体的优缺点列于表2。
表23-2 常见基因转运载体的优缺点
| 载体 | 优点 | 缺点 |
| 逆转录病素毒 | 基因组小并且简单
可稳定整合于宿主基因组 生物学特性清楚 可高效转入复制中的细胞 对宿主细胞无害 |
仅感染分裂细胞
随机整合(可能导致突变) 常常只有短暂表达 病毒滴度低(107pfu/ml) 可能会与有复制能务的病毒重组插入容量有限(10kb) |
| 腺相关病毒 | 基因组小(5kb)
可特异整合于人19号染色体 以人细胞作为宿主 无毒、无致病性 |
尚未研究清楚
需腺病毒辅助复制 携带外源基因能力有限(4kb) 难得到高滴度病毒 |
| 腺病毒 | 适于原位使用,尤其是肺
(在不分裂细胞中可进行高效率的体内感染) 病毒滴度高(1010pfu/ml) 生物学特性清楚 |
不与宿主基因组整合(只有短暂表达)
载本基因组复杂 病毒蛋白可能引起免疫反应及炎症反应 插入外源基因能力有限(7-8kb) |
| 脂质体 | 无感染能力
理论上无DNA大小限制 毒性低 |
无特异性靶细胞
转染效率低 仅有短暂表达 体内应用困难 |
| 受体介导的转运 | 无感染能力
特异性转染靶细胞 理论上无DNA大小限制 构建灵活 |
转染效率低
体内应用困难 可能有免疫原性 只有短暂表达 |
(三)靶细胞的选择
理论上讲,无论何种细胞均具有接受外源DNA的能力,目前基因治疗中禁止使用生殖细胞作为靶细胞,而只能使用体细胞,用于转基因的体细胞必须取材方便,含量丰富,容易培养,寿命较长。可选择的细胞有淋巴细胞、造血细胞、上皮细胞、角质细胞、内皮细胞、成纤维细胞、肝细胞、肌肉细胞和肿瘤细胞等。在实际上应用中应具体根据目的条件选择。
(四)细胞转染(tansfection)
将目的基因导入靶细胞的方法很多,大致可分为物理学方法、化学方法、融合法和病毒感染法四类。病毒法已在本节的“基因的转运”中有基因介绍。目前较多使用的是脂质体法。
表23-3 DNA导入哺乳动物细胞常见的方法
| 名称 | 机制 | 转染效率 | 用途 | 优缺点 | 影响因素 |
| 磷酸钙转染法 | 内吞作用 | 20%细胞被转染 | 瞬时表达 | 1、简单有效 2、适用于贴壁、非贴壁细胞 3、常作首选方法 |
1、Ca2+,DNA浓度
2、PH值,沉淀反应时间 3、氯喹,甘油和丁酸钠处理 |
| DEAE葡聚糖转染法 | 抑制核酸酶
内吞作用 |
在BDC-1,CV-1和COS细胞中较高 | 瞬时表达 | 操作简单 | 1、需高浓度DNa 2、DEAE葡聚糖浓度 3、温育时间 |
| Poly-brene转染法 | 不清楚 | 低分子量DNA转染率高于磷酸钙法 | CHO细胞的稳定转化子 | 能得到较多的稳定转化子 | 1、受体细胞类型
2、转染调控信号 3、DNA浓度 |
| 原生质体融合 | 胞膜融合 | 50-100%转染,稳定子得率为0.2-0.02% | 瞬时表达
稳定表达 |
1、操作复杂
2、不能进行共转染 3、慎用于筛选营养缺陷型变异株 |
1、溶菌酶、PEG浓度
2、温育时间 |
| 电穿孔 | 高压在膜上形成微孔 | 效率较高 | 瞬时表达
稳定转化 |
1、需精密仪器
2、可用于动物、植物细胞和细菌 |
1、电场强度
2、脉冲长度 3、温度,DNA浓度 4、培养液 |
| 脂质体 | 脂膜融合 | 50-60%转染 | 瞬时表达
稳定转化 |
1、操作简单
2、可用于体内试验 |
1、脂质体质量
2、DNA浓度 |
| 胞核微注射法 | 直接注射 | 50-100%转染 | 稳定转化 | 1、需要特殊仪器
2、处理样品数量少 3、高效 |
1、注射技术
2、DNA浓度 |
在目前的技术状态下,一般而言其基因转染效率很难达到100%。故必须首先将转导细胞和未转导细胞加以区分。这方面的新技术发展很快,常用的转导细胞筛选方法有:
利用基因表达产物筛选法:(1)标记基因筛选法:在载体上引入一个标记基因,或同时导入标记基因,在转染后的适当时间选用合适剂量的选择培养基,筛选标记基因表型,那些已导入外源基因的细胞将存活下来,而未转录的细胞则死于选择性细胞培养基。如在较多的载体中都有neor标记基因存在,若向培养基中加入G418进行选择,最后只有转导细胞存活下来。(2)基因缺陷型受体细胞的选择性:以基因缺陷型细胞作为靶细胞,将正常基因导入基因缺陷型靶细胞后,使用选择性培养基进行筛选。例如将TK基因导入TK-的靶细胞,转录细胞可在HAT培养基中生长,未转导的细胞则不能在HAT培养基中生长。(3)基因共转染技术:将目的基因表达载体DNA和标记基因表达载体DNA混合后共同转移到靶细胞中,分别使用标记基因和目的基因对应的选择剂进行两次筛选,最后得到复合转导的转化子。
分子生物学方法:外源基因是否真的转入靶细胞必须用分子杂交方法进行证实。常用的方法有原位杂效,Southern杂交和打点杂交。其中主要问题是探针的选择。若靶细胞内原来不存在所转入的目的基因,可选用目的基因作为探针;靶细胞内一般无标记基因存在,故标记基因是良好的探针。探针大小可以是较大的DNA片段,亦可是人工合成的DNA单链探针分子。PCR方法目前也已用于转导细胞的鉴定,且该法相对简单易行。
(五)外源基因的表达及检测
在筛选出转化分子后还需要鉴定转导细胞中外源基因的表达状况。其中包括对目的基因和标记基因表达的鉴定。常用方法有原位杂交,Northrn杂交,NRA打点杂交,免疫组织化学染色等,前几项是检测外源基因转录出的mRNA,后者则是检测外源基因翻译出的蛋白质。流式细胞仪是一种较为客观准确的仪器,可定量分析外源基因的表达状况。
一些影响基因表达的因素如表4所示。
表23-4 调节重组细胞表达系统的DNA控制元件
| 启动子
病毒启动子:如LTRS,CMV,SV40启动子在短时间后易于关闭,尤其是在逆转录病毒中 看家基因启动子:如二氢叶酸还原启动子可长期表达转基因,但水平很低。 组织/细胞特异性启动子:一些编码含量丰富蛋白的基因的启动子如肌肉中肌酸激酶的启动子能够进行特异性强表达 可诱导启动子:如金属硫蛋白基因的启动子,类固醇诱导的启动子可调节基因表达 |
| 其它调节转录的顺式作用调节元件
增强子,位点控制元件,内含子序列及编码序列本身可影响基因表达调节。 |
| 影响转录后表达的序列
3’-mRNA序列:对于稳定mRNA及进行翻译可能是必需的。 |
三、基因治病的靶向
基因治疗中的靶向问题是基因治疗中急待解决的问题。逆转录病毒载体是目前治疗中应用较为广泛且效果较好的载体。有关逆转录病毒靶向的研究已取得一些进展,使得基因治疗更为安全和有效。
(一)逆转录病毒转导的细胞类型的选择调节
Mo-HLV是一个可广泛转导多种细胞的病毒,为了使其仅感染某些专一性细胞就必须改变其感染谱。
1、改变Mo-HLV感染谱
按宿主范围可将Mo-HLV分为三类:单向性:只能感染啮齿类细胞;异向性:可感染除啮齿类动物细胞以外的其它的细胞;双向性:可感染人及啮齿类动物等大多数细胞。感染细胞的类型是由病毒的外壳蛋白env确定的。
(1)病毒与抗体的偶联:为了使逆转录病毒定向感染所需要的靶细胞,可将病毒与抗体偶联,该抗体则针对所需感染细胞上特有的抗原。如使单向感染病毒与抗人MHC-1。MHC-II的抗体偶联或与抗人表皮生长因子的抗体偶联后,可以感染人类细胞。Goud等使用此法使单向病毒感染人的肝细胞,可惜病毒未能整合入肝细胞基因组,可能其中还有其它原因。
(2)病毒外壳蛋白与配体偶联: 如将env蛋白与乳糖偶联成去延酸糖蛋白,用此法改造的单向逆转录病毒将不再感染原先的宿主而只感染人的肝细胞,因为只有肝细胞表面上含有去延酸糖蛋白的受体。
(3)改变病毒外壳蛋白的识别序列:已发现env蛋白与被感染细胞受体相识别部位的化学组成,如果改变核表位的基因序列,就可能改变感染细胞的类型,但Etienne等认为有一个潜在的、非病毒原有的表位与细胞受体识别之后不能使病毒内化。一种可行的方法是同时表达原有的env蛋白,就能解决内化问题。
2、使用其它逆转录病毒载体:
牛白血病逆转录病毒,猿免疫缺陷病毒,鼠乳腺肿瘤病毒有组织专一性感染的特点,有些研究组利用其作为载体。Page等采用HIV作为病毒载体,Rizvi等用BLV作载体,Morris等采用MMTV作载体,并构建了MMTV独特的包装细胞,使病毒滴度提高百倍以上,但同Mo-MLV相比,其它病毒的滴度偏低。
3、以嵌合逆转录病毒为载体
逆转录病毒感染谱是由病毒颗粒决定的,如果我们改变病毒颗粒蛋白,即保留毒gagpol基因,而env基因来自另一个逆转录病毒,即可改变感染宿主范围。Laudau等用鸟逆转录病毒和RSV的env基因取代Mo-MLVR env基因,Miller等用长臂猿白血病病毒的env基因嵌合Mo-MLVR成功感染了多种细胞,并取得较高的滴度,Gong等用流感病毒的血凝素取代RSV的env基因蛋白,将血凝素成功地嵌入病毒外壳,并能有效感染人和鸟类细胞。Jane等用泡状口炎病毒G糖蛋白取代莫洛尼病毒env蛋白,使该病毒颗粒能成功地感染非哺乳动物如Zebra fish细胞,更重要的是这种病毒外壳可耐受超离心而不影响感染效率,因此有利于浓缩病毒,提高滴度。
(二)目的基因组织专一性表达的调节
许多组织专一性表达的调节片段已研究清楚,把这些片段与目的基因一起重组入逆转录病毒可用于基因的靶向表达。
1、肝专一性表达
肝专一性表达研究较多的是磷酸烯醇式酮酸羧激酶的启动子。McGrane 等用了转基因动物技术使该启动子表达外源基因,证明该启动子专一性地在肝和肾等中表达;Hatzoglau等用PEPCK启动子与neo基因或牛生长因子重组入逆转录病毒载体。克隆后经腹腔注射入子宫感染鼠胎肝或注入门静脉并切除部分肝,证实前病毒可整合肝细胞基因组,并持续表达了八个月之久,而且牛生长因子表达量受食物刺激信号的调节。
另一个肝专一性表达的片段是A-胰蛋白酶基因的顺式作用因子。Simon等的研究表明,α-AT基因上游是决定肝专一性表达的片段,(-137~37)为最短的肝专一性表达的片段。Peng等用α-AT的(-730-30)片段与SV40启动子融合驱动人苯丙氨酸羟化酶基因,使其在肝脏专一性表达,为苯丙酮尿症基因治疗奠定了基础。
α-FP为肝癌细胞特有的高效表达产物,Watanabe等发现其上游调控区(-3700~3300)决定了α-FP在肝癌中的专一性表达。Huber等将片段与你腺嘧啶激酶基因融合,克隆入逆转录病毒后转染肝细胞,然后给予无毒性原药-阿拉伯糖核苷,只有肝癌细胞才专一性地合成TK,批ara-MF转化成细胞毒性ara-ATP,造成肝癌细胞的死亡,而其它感染了α-EF-TK的细胞不受影响。
2、肌肉专一性表达
肌肉中高效表达的是肌苷激酶的调控片段。Johnson等发现MCK调控区有两个增强子:一个位于(-1256~1049),决定肌肉和心肌专一性表达,另一个位于第一内含子(738~1599),只决定在心肌的高效专一性表达。Cox等用这两个增强子使Dystrophin在肌肉的表达量增强50倍,完全纠正了mdr鼠肌肉病理变化,而且无付作用,最近,Yao等用2分MCK增强子(-1350~1048)使人凝血因子IX在肌母细胞中得到高效表达。
3、乳腺专一性表达
在乳腺中专一性表达的基因有β酪蛋白,乳清酸蛋白,鼠乳腺肿瘤病毒,三都调控区中的负调控片段决定他们仅在乳腺组织中表达。
4、黑色素瘤专一性表达
黑色素瘤特异性表达酪氨酸和酪氨酸相关蛋白。决定酪氨酸专一性表达的片段是在该基因上游(-270~1),决定TRP-1专一性表达的区域为(-640~165),Hart等用上述调控区与Gal报告基因融合,在人与鼠的黑色素瘤细胞中均检测到其表达。
5、胶质瘤专一性表达
目前已知鞘磷酸碱性蛋白基因上游(-1300~1)片段决定其在胶质瘤细胞中的专一性表达,Miyao等用该片段与HTK基因融合,转染胶质瘤细胞,在1μMganciclovir培养液中,90%胶质瘤细胞死亡,而对照组生长不受影响。
6、肺癌专一性表达
人表面活性蛋白A是大多数肺癌表达的物质。Smith 等用SPA-1上游(-2600~178)片段驱动HSV-TK基因,转化肺癌细胞株H441,给予ganciclovir后,H441大量死亡。