第十八章 蛋白质的生物合成
(The Biosynthesis of protein)
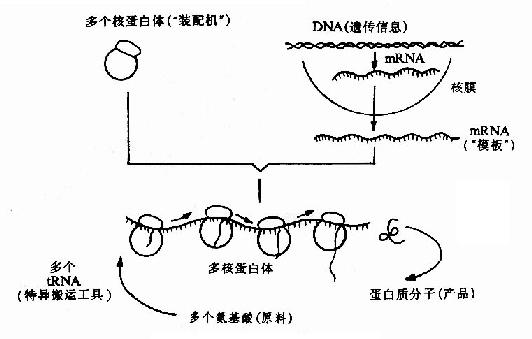
蛋白质分子是由许多氨基酸组成的,在不同的蛋白质分子中,氨基酸有着特定的排列顺序,这种特定的排列顺序不是随机的,而是严格按照蛋白质的编码基因中的碱基排列顺序决定的。基因的遗传信息在转录过程中从DNA转移到mRNA,再由mRNA将这种遗传信息表达为蛋白质中氨基酸顺序的过程叫做翻译。翻译的过程也就是蛋白质分子生物合成的过程,在此过程中需要200多种生物大分子参加,其中包括核糖体、mRNA、tRNA及多种蛋白质因子。翻译基本过程如图18-1。

图18-1 翻译过程的基本原理
第一节 参与蛋白质生物合成的物质
(一)合成原料
自然界由mRNA编码的氨基酸共有20种,只有这些氨基酸能够作为蛋白质生物合成的直接原料。某些蛋白质分子还含有羟脯氨酸、羟赖氨酸、γ-羧基谷氨酸等,这些特殊氨基酸是在肽链合成后的加工修饰过程中形成的。
(二)mRNA是合成蛋白质的直接模板
原核细胞中每种mRNA分子常带有多个功能相关蛋白质的编码信息,以一种多顺反子的形式排列,在翻译过程中可同时合成几种蛋白质,而真核细胞中,每种mRNA一般只带有一种蛋白质编码信息,是单顺反子的形式。mRNA以它分子中的核苷酸排列顺序携带从DNA传递来的遗传信息,作为蛋白质生物合成的直接模板,决定蛋白质分子中的氨基酸排列顺序。不同的蛋白质有各自不同的mRNA,mRNA除含有编码区外,两端还有非编码区。非编码区对于mRNA的模板活性是必需的,特别是5’端非编码区在蛋白质合成中被认为是与核糖体结合的部位。见图18-2。
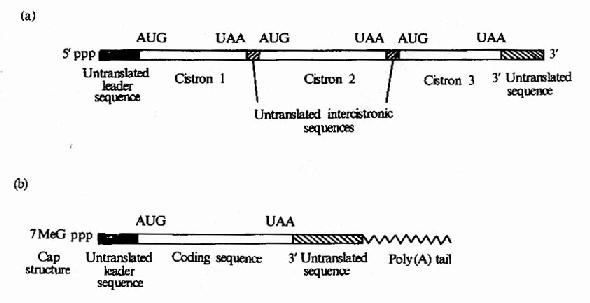
图18-2 (a)原核生物mRNA)为多顺反子
(b)真核生物mRNA为单顺反子
mRNA分子上以5'→3'方向,从AUG开始每三个连续的核苷酸组成一个密码子,mRNA中的四种碱基可以组成64种密码子。这些密码不仅代表了20种氨基酸,还决定了翻译过程的起始与终止位置。每种氨基酸至少有一种密码子,最多的有6种密码子。从对遗传密码性质的推论到决定各个密码子的含义,进而全部阐明遗传密码,是科学上最杰出的成就之一,科学家们设计了十分出色的遗传学和生物化学实验,于1966年编排出了遗传密码字典。见表18-1。
表18-1 氨基酸的密码(code)
| 5’末端(第1位碱基) | 中间碱基(第二位碱基) |
3’末端(第三位碱基) | |||
| U | C | A | G | ||
| U | 苯丙(Pne)F | 丝(Ser)S | 酪(Tyr)Y | 半胱(Cys)C | U |
| 苯内(Pne) | 丝(Ser) | 酪(Tyr) | 半胱(Cys) | C | |
| 亮(Leu)L | 丝(Ser) | 终止信号 | 终止信号 | A | |
| 亮(Leu) | 丝(Ser) | 终止信号 | 色(Trp) | G | |
| C | 亮(Leu) | 脯(Pro)P | 组(His)H | 精(Arg)R | U |
| 亮(Leu) | 脯(Pro) | 组(His) | 精(Arg) | C | |
| 亮(Leu) | 脯(Pro) | 谷胺(Gin)Q | 精(Arg) | A | |
| 亮(Leu) | 脯(Pro) | 谷胺(Gin) | 精(Arg) | G | |
| A | |||||
| 异亮(ILe)I | 苏(Thr)T | 天胺(Asn)N | 丝(Ser)S | U | |
| 异亮(ILe) | 苏(Thr) | 天胺(Asn) | 丝(Ser) | C | |
| 异亮(ILe) | 苏(Thr) | 赖(Lys)K | 精(Arg)R | A | |
| *蛋(Met)M(起动信号) | 苏(Thr) | 赖(Lys) | 精(Arg) | G | |
| G | |||||
| 缬(Val)V | 丙(Ala)A | 天(Asp)D | 甘(Gly)G | U | |
| 缬(Val) | 丙(Ala) | 天(Asp) | 甘(Gly) | C | |
| 缬(Val) | 丙(Ala) | 谷(Glu)E | 甘(Gly) | A | |
| 缬(Val) | 丙(Ala) | 谷(Glu) | 甘(Gly) | G | |
*位于mRNA起动部位AUG为氨基酸合成肽链的起动信号。以哺乳动物为代表的真核生物,此密码子代表蛋氨酸;以微生物为代表的原核生物则代表甲酰蛋氨酸。
遗传密码具有以下几种特点:
(1)起始码与终止码(Initiation codon and termination codon):
密码子AUG是起始密码,代表合成肽链的第一个氨基酸的位置,它们位于mRNA5′末端,同时它也是蛋氨酸的密码子,因此原核生物和真核生物多肽链合成的第一个氨基酸都是蛋氨酸,当然少数细菌中也用GUG做为起始码。在真核生物CUG偶尔也用作起始蛋氨酸的密码。密码子UAA,UAG,UGA是肽链成的终止密码,不代表任何氨基酸,它们单独或共同存在于mRNA3’末端。因此翻译是沿着mRNA分子5′→3′方向进行的。
(2)密码无标点符号:两个密码子之间没有任何核苷酸隔天,因此从起始码AUG开始,三个碱基代有一个氨基酸,这就构成了一个连续不断的读框,直至终止码。如果在读框中间插入或缺失一个碱基就会造成移码突变,引起突变位点下游氨基排列的错误。
(3)密码的简并性(Degemeracy):
一种氨基酸有几组密码子,或者几组密码子代表一种氨基酸的现象称为密码子的简并性,这种简并性主要是由于密码子的第三个碱基发生摆动现象形成的,也就是说密码子的专一性主要由前两个碱基决定,即使第三个碱基发生突变也能翻译出正确的氨基酸,这对于保证物种的稳定性有一定意义。如:GCU,GCC,GCA,GCG都代表丙氨酸。
(4)密码的通用性:
大量的事实证明生命世界从低等到高等,都使用一套密码,也就是说遗传密码在很长的进化时期中保持不变。因此这张密码表是生物界通用的。然而,出乎人们预料的是,真核生物线粒体的密码子有许多不同于通用密码,例如人线粒体中,UGA不是终止码,而是色氨酸的密码子,AGA,AGG不是精氨酸的密码子,而是终止密码子,加上通用密码中的UAA和UAG,线粒体中共有四组终止码。内部甲硫氨酸密码子有两个,即AUG和AUA;而起始甲硫氨酸密码子有四组,即AUN。
密码子结构与氨基酸侧链析性之间也有一定关系。①氨基酸侧链极性性质在多数情况下由断面子的第二个碱基决定。第二个碱基为嘧啶(Y)时,氨基酸侧链为非极性,第二个碱基为嘌呤时,氨基酸侧链则有极性。②当第一个碱基为U或A,第二个碱基为C,第三个碱基无特异性时,所决定的氨基酸侧链为极性不带电。③当第一个碱基不是U,第二个碱基是P时,氨基酸侧链则带电。在此前提下,若是一个是C或A时,表示带正电的氨基酸,第一、二个碱基分别是G、A时,此种氨革酸带负电,但上述关系也有个别例外。
一种氨基酸由多种密码子所编码的事实使人想到:同一种氨基酸的一组密码子的使用频率是否相同?许多实验证实,在原核生物和高等真核生物中同一组密码子的使用频率是不相同的。高频密码子多出现在那些表达量高的蛋白质基因中,例如,核糖体蛋白质基因,RecA蛋白质基因等。表18-2。这种使用频率与细胞内一组tRNA中的不同tRNA含量有关。
(三)tRNA是氨基酸的运载工具:
tRNA在蛋白质生物合成过程中起关键作用。mRNA推带的遗传信息被翻译成蛋白质一级结构,但是mRNA分子与氨基酸分子之间并无直接的对应关系。这就需要经过第三者“介绍”,而tRNA分子就充当这个角色。tRNA是类小分子RNA,长度为73-94个核苷酸,tRNA分子中富含稀有碱基和修饰碱基,tRNA分子3’端均为CCA序列,氨基酸分子通过共价键与A结合,此处的结构也叫氨基酸臂。每种氨基酸都有2-6种各自特异的tRNA,它们之间的特异性是靠氨基酰tRNA合成酶来识别的。这样,携带相同氨基酸而反密码子不同的一组tRNA称为同功tRNA,它们在细胞内合成量上有多和少的差别,分别称为主要tRNA和次要tRNA。主要tRNA中反密码子识别tRNA中的高频密码子,而次要tRNA中反密码子识别mRNA中的低频密码子。每种氨基酸都只有一种氨基酰tRNA合成酶。因此细胞内有20种氨基酰tRNA合成酶。
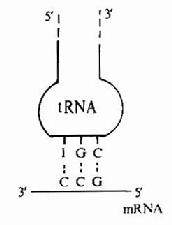
图18-3 密码子和反密码子的相互作用
tRNA分子中还有一个反密码环,此环上的三个反密码子的作用是与mRNA分子中的密码子靠碱基配对原则而形成氢键,达到相互识别的目的。但在密码子与反密码子结合时具有一定摆动性,即密码子的第3位碱基与反密码子的第1位碱基酸对时并不严格,见图18-3。配对摆动性完全是由tRNA反密码子的空间结构所决定的。反密码的第1位碱基常出现次黄嘌呤I,与A、C、U之间皆可形成氢键而结合,这是最常见的摆动现象。这种摆动现象使得一个tRNA所携带的氨基酸可排列在2-3个不同的密码子上,因此当密码子的第3位碱基发生一定程度的突变时,并不影响tRNA带入正确的氨基酸。
表18-3 反密码与密码碱基配对时的摇摆现象
| 反密码第1位碱基 | A | C | G | U | 1 |
| 密码第3位碱基 | U | G | C,U | A,G | A,C,U |
在蛋白质生物合成过程中,特异识别mRNA上起始密码子的tRNA被称为起始tRNA,它们参加多肽链合成的起始,其它在多肽链延伸中运载氨基酸的tRNA,统称为延伸tRNA。
(四)核糖核蛋白体
核蛋白体是由rRNA和几十种蛋白质组成的亚细胞颗粒,位于胞浆内,可分为两类,一类附着于粗面内质网,主要参与白蛋白、胰岛素等分泌性蛋白质的合成,另一类游离于胞浆,主要参与细胞固有蛋白质的合成。核糖体是细胞中的主要成分之一,在一个生长旺盛的细菌中大约不20000个核糖体,其中蛋白质占细胞总蛋白质的10%,RNA占细胞总RNA的80%。
任何生物的核糖体都是由大、小两个亚基组成,现将大肠杆菌核糖体和大鼠肝细胞核糖体的蛋白质组分和RNA组成列表于18-4。1968年已在体外对大肠杆菌小亚基进行了自我装配研究,加入16s rRNA和21种蛋白质,即可形成有天然活性的30s小亚基。通过这些研究使人们能够进一步认识小亚基和大亚基中rRNA与蛋白质的特异功能。核糖体是高度复杂的体系,它的任何个别组分或局部组分都不能起整体的作用,因此必须研究核糖体中蛋白质和RNA的空间结构和位置,才能更完全地了解蛋白质合成的具体过程。过去一直认为rRNA主要起着结构上的作用,蛋白质发挥催化功能,但现在认为rRNA与蛋白质共同的构成的核糖体功能区是核蛋白体表现功能的重要部位,如GTP酶功能区,转肽酶功能区以及mRNA功能区等等。
表18-4 核蛋白体的组成及特性
| 来源 | 直径(毫微米) | 重量(道尔顿) | 含rRNA(%) | 含蛋白质(%) | 沉降系数 | 亚基 | 含rRNA | 含蛋白质种数 | 每个细胞内含有的个数 | |
| 种类 | 分子量 | |||||||||
| 真核细胞胞液 | 20~22 | 3.6×106 | 55 | 45 | 77S~80s | 40S(小) | 18S | -70万 | ~34 | 106~107 |
| 60S(大) | 5s 5.8S 28S~29S |
3万
4万 140~180万 |
~40 | |||||||
| 原核细胞胞液 | 18 | 2.6×106 | 60~65 | 30~35 | 70S | 30S(小) | 16S | 55万 | ~34 | 1.5×104 |
| 50S(大) | 5s 23S |
4万
110万 |
||||||||
注:真核细胞线粒体的核蛋白体组成及特性与原核细胞胞液的相同
核蛋白体作为蛋白质的合成场所具有以下几种作用:
(1)mRNA结合位点:位于30s小亚基头部,此处有几种蛋白质构成一个上的结构域,负丙与mRNA的结合,特别是16srRNA3’端与mRNa AUG之前的一段序列互补是这种结合必不可少的,见表18-5。
表18-5 大肠杆菌mRNA起始密码上游区域SD序列和16s rRNA的互补
| MS2外壳蛋白
MS2复制酶 MS2A蛋白 λCro galE β-内酰氨酶 脂蛋白 核糖体蛋白S12 RNA聚合酶β trpE |
3’HOAU UCCUCCACUAG……5’
5’……UCAACC GGAGUUUGAAUCAUG…3’ 5’……CAAACAU GAGGAUUACCCAUG …3’ 5’…… UCCU AGGAGGUUUGACCUGUG…3’ 5’…… AUGUAC UAAGGAGGUUGUAUG…3’ 5’…… AGCCUAAU GGAGCGAAUUAUG…3’ 5’…… UAUUGAAA AAGGAAGAGUAUG…3’ 5’…… AUCUA GAGGGUAUUAAUAAUG…3’ 5’…… AAAACCAGGAGCUAUUUAAUG…3’ 5’…… AGCGAGCU GAGGAACCCUAUG…3’ 5’…… CAAAAUUAGAGAAUAACAAUG…3’ |
(2)P位点:(peptidyl tRNA site)
又叫做肽酰基tRNA位或给位。它大部分位于小亚基,小部分位于大亚基,它是结合起始tRNA 并向A位给出氨基酸的位置(图18-4)。
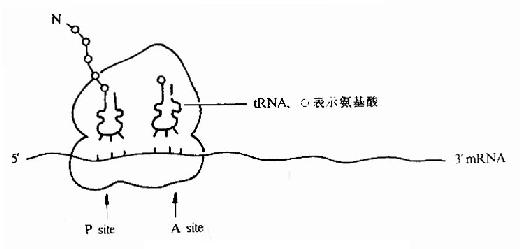
图18-4 翻译过程中的核糖体图解
(3)A位点:(Aminoacyl-tRNA site)
叫做氨基酰 tRNa 位或受位。它大部分位于大亚基而小部分位于小亚基,它是结合一个新进入的氨基酰tRNA 的位置(见后节叙述)。
(4)转肽酶活性部位:
位于P位和A位的连接处。
(5)结合参与蛋白质合成的起始因了(Initiation Factor,IF)、延长因子(Elengation Factor,EF)和终止因子或释放因子(Release Factor,RF)。