
第二节 急性炎症
炎症通常可依病程经过分为两大类:急性炎症(acute inflammation)和慢性炎症(chronic inflammation)。急性炎症起病急骤,持续时间短,仅几天到一个月,以渗出病变为其特征,炎症细胞浸润以粒细胞为主。慢性炎症持续时间较长,常数月到数年,常以增生病变为主,其炎症细胞浸润则以巨噬细胞和淋巴细胞为主。
鉴于抵抗病原微生物的两种主要成分,即白细胞和抗体均靠血液运输,因而在急性炎症中血液动力学改变、血管通透性增高和白细胞渗出这三种改变十分明显。结果造成富含蛋白质的渗出液、纤维蛋白及白细胞在损伤部位的血管外间隙积聚。这就是急性炎症病理组织学的主要特征。
一、血液动力学改变
组织受损伤后的微循环很快发生血液动力学变化,即血液的血管口径的改变,病变发展速度取决于损伤的严重程度。血液动力学的变化一般按下列顺序发生(图5-1)。
1.细去脉短暂收缩 损伤发生后迅即发生短暂的细动脉收缩,持续仅几秒钟。其机制可能是神经源性的,但某些化学介质也能引起血管收缩。
2.血管扩张、血流加速 先累及细动脉,随后导致更多微血管床开放,局部血流量增加,此乃急性炎症早期血液动力学改变的标志,也是局部红、热的原因。
血管扩张的发生机制与神经和体液因素均有关。神经因素即所谓轴突反射。以炎症介质所代表的体液因素对血管扩张的发生起更为重要的作用。
3.血流速度减慢血流速度减慢是微血管通透性升高的结果。富含蛋白质的液体向血管外渗出导致血管内红细胞浓集和粘稠度增加。最后扩张的小血管内挤满了红细胞,称为血流停滞(stasis)。
4.白细胞附壁 随血流停滞的出现,微血管血液中的白细胞,主要是中性粒细胞始边集(leukoctytic margination)并与内皮细胞粘附,这一现象称为白细胞附壁。随后白细胞借阿米巴样运动游出血管进入组织间隙。
血液动力学变化所经历的时间与刺激的种类和强度有关。极轻度刺激所引起的血流加快仅持续10~15分钟,然后逐渐恢复正常;轻度刺激下血流加快,可持续几小时,接着血流变慢,甚至停滞;较重刺激下可在15~30分钟出现血流停滞,而严重损伤常仅需几分钟就可出现血流停滞。此外,局部血液动力学改变还与距离损伤因子远近有关,例如皮肤烧伤病灶的中心可能已发生了血流停滞,而周边部的血管尚处于扩张状态。

正常血流

血管扩张,血流加快

血管进一步扩张,血流开始变慢,血浆渗出

血流变慢,白细胞游出血管外
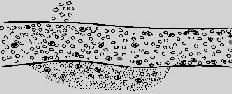
血流显著变慢,除白细胞游出外,红细胞漏出
图5-1 血液动力学变化模式图
二、血管通透性升高
炎性水肿除了在炎症的最早阶段是由于血管扩张、血流速度加快导致流体静力压升高、血浆超滤,使基本不含蛋白质的液体从毛细血管滤出所致外,富含蛋白质的渗出液的产生则主要是由血管通透性增加造成的。由于大量蛋白质从血浆到达血管外间质,使血浆胶体渗透压降低,而组织胶体渗透压升高,使更大量液体聚集在间质内,从而形成炎性水肿或浆膜腔炎性积液。
微循环血管通透性的维护,主要依赖于内皮细胞的完整性。在炎症过程中,下列机制可引起血管通透性的增加(图5-2)。
1.内皮细胞收缩在组胺、缓激肽和其它炎症介质与内皮细胞受体结合后,可迅速引起内皮细胞收缩,致使内皮细胞间形成宽约0.5~1.0μm的缝隙。由于这些炎症介质的半寿期较短仅15~30分钟,故这种反应被称为速发短暂反应(immediate transient response)。此反应仅累及20~60μm口径的细静脉,而细动脉和毛细血管不受累。抗组胺药物能抑制此反应。
2.直接内皮损伤 如严重烧伤和化脓菌感染等严重刺激可直接造成内皮细胞损伤,使之坏死和脱落。血管通透性增加发生迅速,并在高水平上持续几小时到几天,直至受损血管内形成血栓,此过程被称作速发持续反应(immediate-sustained response)。细动脉、毛细血管和细静脉各级微循环血管均可受累。
轻、中度热损伤、X线和紫外线损伤以及某些细菌毒素所引起的内皮细胞直接损伤等则发生较晚,常在2~12小时之后,但可持续几小时到几天,称为迟发持续反应(delayed prolonged response)。此反应仅累及毛细血管和小静脉。
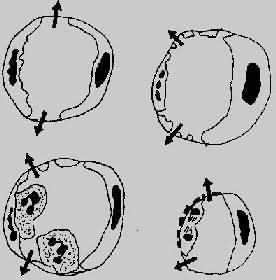
图5-2 血管通透性增加的四种机制模式图
左上图示内皮细胞收缩,累及细静脉;
右上图示直接损伤内皮细胞,累及全部微循环;
左下图示白细胞介导之内皮损伤,主要累及细静脉和毛细血管;
右下图示再生内皮细胞,主要累及毛细血管
3.白细胞介导的内皮损伤 在炎症的早期,白细胞附壁并与内皮细胞粘附,引起白细胞的激活,释放具有活性的氧代谢产物和蛋白水解酶。后者可引起内皮细胞的损伤或脱落,使血管通透性增加。
4.新生毛细血管壁的高通透性在修复过程中所形成的新生毛细血管芽,其内皮细胞连接发育不成熟,可说明愈复性炎症中的液体外渗和水肿。
应该指出,上述四种机制在对某些刺激的反应过程中均发挥其作用。例如在热损伤的不同阶段,血管通透性增加所导致的液体外渗,可由化学介质造成的内皮细胞收缩、白细胞介导的内皮损伤、内皮的直接损伤和新生毛细血管壁的通透性引起。不同化介质可能相继被激活,从而导致持续反应。
局部炎性水肿可稀释毒素,减轻对局部的损伤作用;为局部浸润的白细胞带来葡萄糖、氧等营养物质,并带走代谢产物;渗出物所含的抗体和补体等物质,有利于消灭病原体;渗出物中的纤维蛋白原所形成的纤维素交织成网,一方面可限制病原微生物的扩散,使病灶局限化,另一方面也有利于吞噬细胞发挥吞噬作用,在炎症的后期纤维素网还可成为修复的支架,并有利于纤维母细胞产生胶原纤维;渗出物中的病原微生物和毒素随淋巴液被携带到局部淋巴结,可刺激机体产生细胞和体液免疫。
但如果渗出液过多,则可影响器官功能和压迫邻近器官,例如肺胞内渗出物堆集可影响换气功能,心包和胸腔积液可压迫心、肺、严重的喉头水肿可引起窒息,等等。纤维素性渗出物如果不能被完全吸收,则发生机化,例如在肺可引起肺肉质变在浆膜腔可引起浆膜粘连甚至浆膜腔闭锁。
三、白细胞的渗出和吞噬作用
炎症反应的最重要功能是将炎症细胞输送到炎症局部,白细胞的渗出是炎症反应最重要的特征。中性粒细胞和单核细胞渗出可吞噬和降解细菌、免疫复合物和坏死组织碎片,构成炎症反应的主要防御环节。但白细胞也可通过释放酶、化学介质和毒性自由基等,引起组织损伤并可能延长炎症过程。
白细胞的渗出过程是极其复杂的,经过附壁、粘着、游出和趋化作用等阶段到达炎症灶,在局部发挥重要的防御作用。
1.附壁 随着血管扩张、血管通透性增加和血流缓慢,白细胞离开轴流,并沿内皮滚动。此时内皮细胞表面衬覆一层滚动的白细胞,犹如在人行道上前进的人群。最后白细胞粘附于血管内皮细胞。
2.粘着 虽然多种因素影响着内皮细胞与白细胞的粘着,诸如内皮细胞和白细胞表面负电荷被中和而相互排斥力下降,二价阳离子桥接内皮细胞与白细胞而促进粘着等,但现在明了这种粘着是内皮细胞和白细胞表面粘附分子(adhesion motecule)相互识别引起的。炎平可使内皮细胞和炎症细胞表达新的粘附分子,增加粘附分子的数目和增强彼此的亲合性。
某些因子作用于内皮细胞,而另一些作用于白细胞,还有一些作用于两者,促进粘附分子的表达。
(1)白细胞表面粘附分子的表达:在补体C5a作用下白细胞增加三种整合蛋白类糖蛋白的表达。整合蛋白是由不同的α单位和β亚单位构成的异二聚体,具有广泛的生物功能。促进白细胞与内皮细胞粘着而表达于白细胞的整合蛋白包括LFA-1、MAC-1和P150-95(即CD11/CD18复合物)。C5a不仅可促进这三种整合蛋白的表达,还可改变其构象而增加与配体的亲合性。
(2)内皮细胞表面粘附分子的表达:在内皮细胞表面MAC-1和LFA-1的配体是细胞间粘附分子1(intercellular adhesion molecule 1,ICAM-1)。在IL-1和其它一些炎症介质的作用下,内皮细胞可增加细胞表面粘附分子的表达。高表达内皮细胞白细胞粘附分子1(endothelial leukocyte adhesion molecule 1,ELAM-1)可促进中性粒细胞的粘着;高表达ICAM-1促进中性粒细胞和淋巴细胞的粘着;血管细胞粘附分子(vascular cell adhesion molecule1,VCAM-1)促进淋巴细胞和单核细胞粘着。
(3)肿瘤坏死因子(TNF)则可促进内皮细胞和白细胞粘附分子的表达。
3.游出和趋化作用 白细胞通过血管壁进入周围组织的过程称为游出(emigration)。粘着于内皮细胞表面的白细胞沿内皮表面缓慢移动,在内皮细胞连接处伸出伪足,整个白细胞逐渐以阿米巴运动方式从内皮细胞缝隙逸出,到达内皮细胞和基底膜之间,最终穿过基底膜到血管外(图5-3)。用电子显微镜可追踪此游出轨迹。一个白细胞通常需2~12分钟才能完全通过血管壁。中性粒细胞、单核细胞、淋巴细胞、嗜酸性和嗜碱性粒细胞都是以此种阿米巴运动方式游出的。血管壁受严重损伤时红细胞也可漏出,但这是个被运过程,是流体静压力把红细胞沿白细胞游出的途径或内皮细胞坏死崩解的裂口推出血管外。

图5-3 中性粒细胞的附壁和游出
注入致炎因子(毒素)10小时后的局部小静脉,可见四个中性粒细胞,1.中性粒细胞与多个红细胞(RBC)位于血管腔内,2.中性粒细胞正穿过血管壁到达血管外,3.中性粒细胞位于内皮细胞(E)和周细胞(P)之间,4.中性粒细胞游出达到血管外×4000
炎症的不同阶段,游出的白细胞也不同。在急性炎症的早期,中性粒细胞首先游出。48小时后组织内则以单核细胞浸润为主,其原因首先在于中性粒细胞的寿命短,经24~48小时中性粒细胞崩解消失,而单核细胞在组织内存活时间长;中性粒细胞停止游出后,单核细胞仍可持续游出;第三个因素为在炎症的不同阶段所激活的趋化因子不同。现已证实中性粒细胞能释放单核细胞趋化因子,因此中性粒细胞游出后必然引起单核细胞的游出。此外,由于致炎因子不同,渗出的白细胞也不同:常见的葡萄球菌和链球菌感染,以中性粒细胞渗出为主;病毒感染以淋巴细胞为主;在一些过敏反应,则以嗜酸性粒细胞渗出为主。
趋化作用(chemotaxis)是指白细胞向着化学刺激物所在部位作定向移动,移动速度约每分钟5~20μm。这些化学刺激物称为趋化因子。研究白细胞的趋化作用可采用微孔滤膜Boyden小室技术的和显微缩时摄影技术记录白细胞的运动轨迹。研究发现,趋化因子的作用是有特异性的,有些趋化因子只吸引中性粒细胞,而另一些趋化因子则吸引单核细胞,或嗜酸性粒细胞等。此外,不同细胞对趋化因子的反应能力也不同。粒细胞和单核细胞对趋化因子的反应较显著。而淋巴细胞对趋化因子的反应则较弱。
一些外源性和内源性化学物质具有趋化作用。常见的白细胞趋化因子包括可溶性细菌产物、补体系统成分(特别是C5a)和花生四烯酸经脂质加氧酶途径的代谢产物(特别是白细胞三烯B4)等。单核细胞还对中性粒细胞的衍生物、致敏淋巴细胞所释放的因子及纤维粘连蛋白断片起趋化反应。在Ⅰ型变态反应中,IgE致敏的肥大细胞或嗜碱性粒细胞在同种抗原的刺激下,可释放过敏反应嗜酸性粒细胞趋化因子(EFC-A),致使嗜酸性粒细胞积聚。此外致敏淋巴细胞释放的因子和C5a也是嗜酸性粒细胞的趋化因子。
白细胞如何“发现”趋化因子,趋化因子又如何引起白细胞定向运动?首先,白细胞表面有趋化因子的受体,在各种趋化因子与其特异性受体结合后可引起一系列信号传导通路成分的改变,尽管其全部机制并未彻底揭开。在趋化因子与白细胞表面的受体激活后可激活磷脂酶C,导致4,5二磷酸磷脂酰肌醇水解,产生三磷酸肌醇和二乙酰基甘油,进而使细胞内游离钙离子升高,首先是细胞内储存钙释放,然后是细胞外钙离子通过钙通道进入细胞内。由于细胞内钙离子浓度升高,细胞内便组装可引起细胞运动的收缩成分。此外在趋化因子与受体结合后还能激活磷脂酶A2,后者将细胞膜磷脂转换成花生四烯酸。二乙酰基甘油通过激活蛋白激酶C在白细胞激活的不同阶段、脱颗粒和分泌过程中发挥作用。
4.白细胞在局部的作用 游出的白细胞在炎症灶局部发挥吞噬作用(phagocytosis)和免疫作用,能有效地杀伤病原微生物,因而成为炎症防御反应中极其重要的一环。
(1)吞噬作用:吞噬作用是指白细胞游出到炎症灶,吞筮病原体以及组织碎片的过程。完成此功能的吞噬细胞主要有两种;中性粒细胞和巨噬细胞,其吞噬异物的过程基本相同,但其结构和化学成分则有所不同。
1)吞噬细胞的种类:中性粒细胞直径10~12μm,胞核呈杆状或分叶状,通常为2~5叶,叶间有染色质丝相连,核染色质呈块状,着色深。细胞浆内富含中性颗粒,相当于电镜下的溶酶体。在电镜下,中性颗粒可分为嗜苯胺蓝颗粒和特异性颗粒两种。前者又称嗜天青颗粒,体积较大、电子密度高,约占全部颗粒的10%~20%。含有酸性水解酶、中性蛋白酶、髓过氧化物酶、阳离子蛋白、溶菌酶及磷脂酶A2等。特异性颗粒较小、电子密度较低,占全部颗粒的80%,含有溶菌酶、磷脂酶A2、乳铁蛋白及碱性磷酸酶等。
炎症灶内的巨噬细胞,大多来自血液的单核细胞,直径为14~17μm。细胞核呈肾形或弯曲折叠的不规则形,染色质颗粒纤细而疏松,故着色较浅。胞浆较丰富,内有大小、致密度和形态均不一致的溶酶体,富含酸性磷酸酶和氧化酶。巨噬细胞受外界刺激能被激活,表现为细胞体积增大,细胞表面皱襞增多,线粒体和溶酶体增多,其功能也相应增强。
2)吞噬过程:包括识别和粘着、吞入及降解三个阶段。
①识别和粘着:在无血清存在的条件下,吞噬细胞很难识别并吞噬细菌。因为在血清中存在着调理素(opsonin),即一类能增强吞噬细胞吞噬活性的血清蛋白质,主要是IgG和C3b。吞噬细胞藉其表面的Fc受体和C3b(C3bi或Mac-1),能识别被抗体或补体包被的细菌,经抗体或补体与相应受体结合,细菌就被粘着在吞噬细胞的表面(图5-4)。
②吞入:细菌粘着于吞噬细胞表面之后,吞噬细胞乃伸出伪足,随伪足延伸和互相吻合,形成由吞噬细胞包围吞噬物的泡状小体,谓之吞噬体(phagosome)。吞噬体逐渐脱离细胞膜进入细胞内部,并与初级溶酶体融合,形成吞噬溶酶体(phagolysosome),溶酶体内容物倾注其中,细菌在吞噬溶酶体内被杀伤、降解。
③杀伤和降解:进入吞噬溶酶体的细菌主要是被具有活性的氧化代谢产物杀伤的。吞噬过程使白细胞的耗氧量激增,可达正常消耗量的2~20倍,并激活白细胞氧化酶(NADPH氧化酶),后者使还原型辅酶Ⅱ(NADPH)氧化而产生超氧负离子(O2-)。
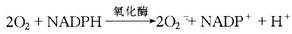
大多数超氧负离子经自发性歧化作用转变为H2O2。在中性粒细胞的嗜天青颗粒中存在着髓过氧化物酶(MPO),在有氯化物存在的条件下,该酶可将H2O2还原生成次氯酸HOCL·)(图5-5)。
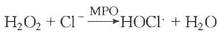
HOCL·是强氧化剂和杀菌因子。羟自由基是另一种杀菌因子。
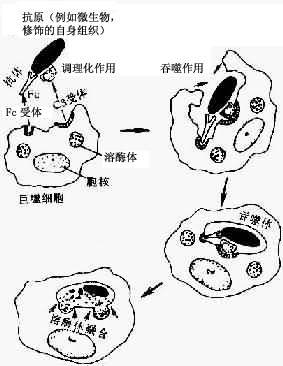
图5-4吞噬过程示意图
示吞噬细胞的识别和吞入
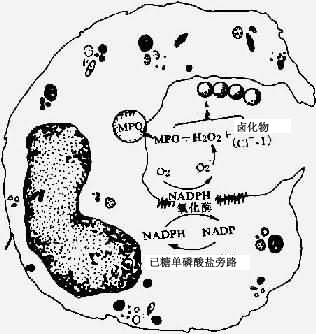
图5-5 吞噬细胞的氧化代谢活性产物杀菌机制图解
氧代谢产物可通过下列途径杀菌:
①与细菌细胞膜磷脂分子中的高度不饱和脂肪酸发生脂质过氧化反应,导致细胞膜的生理状态破坏,细胞膜对阳离子的通透性升高。细菌内游离钙离子浓度的升高,可激活钙依赖性磷脂酶和某些蛋白激酶,从而造成细菌的损伤和死亡。
②与氨基酸、蛋白质和糖分子上的某些反应基因发生氧化还原反应,使具有重要生理功能的酶失去活性,一些大分子物质改变其物理和生物学特性。
③可穿过细胞膜进入细胞内部,与细菌内部分子起作用。
④与细菌的DNA发生反应,促进姐妹染色单体交换。此外脂质过氧化物在分解过程中产生丙二醛,后者与DNA发生交联,从而影响DNA复制,阻断细菌繁殖,最后导致细菌死亡。
因此,H2O2-MPO-CL-系统是最有效的杀菌系统,其杀菌效能比单独H2O2强50倍,而且对细菌、真菌、支原体和病毒均有杀伤效应。
白细胞颗粒中那些不依赖氧的物质也能杀伤病原体,包括增加细菌通透性蛋白(bacterial permeability-increasing protein,即BPI蛋白)、溶菌酶(水解细胞之细胞壁)、乳铁蛋白和一组新发现的富含精氨酸的阳离子蛋白质,后者能溶解细菌细胞壁,被称作杀菌(phagocytin)或防御素(defensins)。吞噬作用完成后,吞噬溶酶体内的pH降至4~5,其内的酸性水解酶就可在此种合适的的pH环境下发挥降解细菌的作用。
通过吞噬细胞的上述杀伤作用,大多数病原微生物被杀伤。但有些细菌,在白细胞内处于静止状态,仍具有生命力和繁殖力,如结核杆菌,一旦机体抗抵力下降,这些病原体又能繁殖,并可随吞噬细胞的游走而在体内播散。生活在吞噬细胞内的细菌难以受到抗生素和机体防御机制的影响,故很难在机体内消灭。
(2)免疫反应:免疫反应需淋巴细胞、浆细胞和巨噬细胞的协同作用。淋巴细胞大小不一,直径6~16μm。胞核圆形或卵圆形,核的一侧常有小凹陷,核染色质呈致密块状,故着色深。胞浆少,可见少数不含过氧化酶的嗜苯胺蓝颗粒。淋巴细胞又分为T细胞和B细胞。浆细胞形状特殊,呈一端稍粗的卵圆形,核呈圆形,位于细胞的较粗端一侧,在胞浆侧与胞浆间有一亮晕核的异染色质丰富呈轮辐状排列。胞浆略嗜碱性,电镜下富含粗面内质网。其功能在于产生抗体。
抗原进入机体后,巨噬细胞将其吞噬处理,再把抗原递呈给T和B细胞,使其致敏。免疫活化的淋巴细胞分别产生淋巴因子和抗体,发挥其杀伤病原微生物的作用。
淋巴细胞和浆细胞浸润常见于慢性炎症,尤其是与细胞免疫有关的慢性肉芽肿性炎症,如结核、梅毒等。
(3)组织损伤:在某些情况下,白细胞激活后可向细胞外间隙释放其产物,这些产物包括溶酶体酶、氧源性代谢产物和花生四烯酸代谢产物(前列腺素和白细胞三烯)等。这些产物本身有强烈的介导内皮细胞和组织损伤的作用及加重原始炎症刺激因子的损伤效能。这种白细胞介导的组织损伤在许多人类炎症性疾病中都能见到,类风湿性关节炎便是一个明显的例证。
5.白细胞的功能缺陷如前所述,白细胞在机体的防御反应中起着极其重要的作用。先天性和获得性白细胞功能缺陷将造成病人的反复感染。从白细胞先天性功能缺陷的病例可加深对白细胞在炎症反应中的作用的认识。现举例说明如下:
(1)吞噬功能缺陷:可表现在从与内皮细胞的粘着到杀菌活性的全过程。
1)粘着缺陷:典型的例子是白细胞粘着缺陷(leukocyte adhesion deficiency), 见于常染色体隐生遗传病,其发病机制在于LFA-1和Mac-1中的β链生物合成缺陷,因而影响白细胞粘着于内皮细胞。
2)识别障碍:主要因调理素缺乏,见于丙种球蛋白缺乏症及补体缺乏。
3)趋化作用缺陷:可表现为白细胞运动能力降低和趋化因子产生障碍,如在Chédiak-Higashi综合征(常染色体隐性遗传性疾病),以白细胞胞浆内出现巨大溶酶体为其特征,存在多种异常,包括微管组装障碍,因而影响白细胞的位移。而先天性补体缺乏则使趋化因子生成障碍。
4)吞入或脱颗粒障碍:在Chédiak-Higashi综合征时,由于微管组装障碍,而影响溶酶体内容物倾入吞噬小体,影响白细胞的杀菌能力,因而病人表现为反复化脓性感染。中性粒细胞肌动蛋白功能障碍(actin dysfunction)影响病原体的吞入。当然,调理素缺乏亦影响病原体的吞入。
5)杀伤作用缺陷:H2O2产生障碍见于慢性肉芽肿病(chronic granulomatous disease,CGD),它是X连锁遗传性疾病,男性婴儿和儿童患病,是由于NADPH氧化酶缺乏,故影响H2O2的产生,导致H2O2-MPO-CL-杀菌功能不良。一般细菌在代谢过程中能产生少量H2O2,但有的细菌能产生分解H2O2的过氧化氢酶,如金黄色葡萄球菌,所以该细菌可在CGD患者体内存活下来。而肺炎双球菌等产生少量H2O2,却不产生过氧化氢酶,这些H2O2则足以启动H2O2-MPO-CL-杀菌功能系统,而将细菌杀死。因此CGD病人常表现为过氧化氢酶阳性细菌的感染。这类病例说明活性氧化代谢产物在杀灭病原微生物中的重要作用。
某些疾病如Chédiak-Higashi综合征和糖尿病,则因多个环节缺陷而影响吞噬作用。
(2)免疫反应缺陷:主要是先天性免疫缺陷,严重损伤机体的免疫功能及炎症反应。例如B细胞缺陷(Bruton综合征)、T细胞缺陷(Di George综合征),以及联免疫缺陷病等。
了解急性炎症过程的基本病变就可清楚地阐明炎症的局部表现。炎症局部小血管呈明显而又持续性地扩张,致使局部组织发红。发生在体表或接近皮肤的炎症,由于局部血流量增多,故局部发热。肿胀的主要原因是局部水肿和渗出物积聚。对局部疼痛的机制目前还不十分清楚,某些炎症的介质如缓激肽和某些前列腺素可引起疼痛。因局部水肿和渗出物积聚所引起的组织内张力增高可能是疼痛最重要的因素,因此脓肿在局部排脓后疼痛症状可立即缓解。局部功能障碍是由于疼痛而反射性地抑制肌肉活动,以及局部水肿使活动受限所致。
四、炎症介质
急性炎症反应中的血管扩张、通透性升高和白细胞渗出的发生机制,是炎症发生机制的重要课题。有些致炎因子可直接损伤内皮,引起血管通透性升高,但许多致炎因子并不直接作用于局部组织,而主要是通过内源性化学因子的作用而导致炎症,故又称之为化学介质或炎症介质(inflammatory mediator)。
1.细胞释放的炎症介质
(1)血管活性胺:包括组胺和5-羟色胺(5-HT)。组胺主要存在于肥大细胞和嗜碱性粒细胞的颗粒中,也存在于血小板。引起肥大细胞释放组胺的刺激包括:①创伤或热等物理因子;②免疫反应,即抗原与结合于肥大细胞表面的IgE相互作用时,可使肥大细胞释放颗粒;③补体片断,如过敏毒素(anaphylatoxin);④中性粒细胞溶酶体阳离子蛋白;⑤某些神经肽。在人类,组胺可使细动脉扩张,细静脉内皮细胞收缩,导致血管通透性升高。组胺可被组胺酶灭活。组胺还有对嗜酸性粒细胞的趋化作用。
5-HT由血小板释放,胶原和抗原抗体复合物可刺激血小板发生释放反应。虽然在大鼠其作用与组胺相似,但在人类炎症中的作用尚不十分清楚。
(2)花生四烯酸代谢产物:包括前列腺素(PG)和白细胞三烯(leukotriene,LT),均为花生四烯酸(arachidonic acid,AA)的代谢产物。AA是二十碳不饱和脂肪酸,是在炎症刺激和炎症介质(如C5a)的作用下激活磷脂酶产生的,在炎症中,中性粒细胞的溶酶体是磷脂酶的重要来源。AA经环加氧酶和脂质加氧酶途径代谢,生成各种产物(图5-6)。
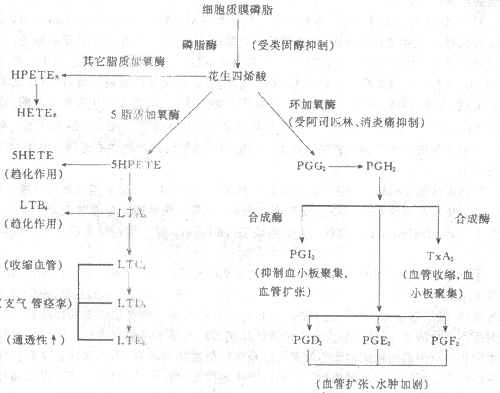
图5-6 炎症过程中花生四烯酸的代谢
总之,炎症刺激花生四烯酸代谢并释放其代谢产物,导致发热、疼痛、血管扩张、通透性升高及白细胞渗出等炎症反应。另一方面,抗炎药物如阿司匹林、消炎痛和炎固醇激素则能抑制花生四烯酸代谢、减轻炎症反应。
(3)白细胞产物 被致炎因子激活后,中性粒细胞和单核细胞可释放氧自由基和溶酶体酶,促进炎症反应和破坏组织,成为炎症介质。
1)活性氧代谢产物:其作用包括三个方面:①损伤血管内皮细胞导致血管通透性增加。②灭活抗蛋白酶(如可灭活α1抗胰蛋白酶),导致蛋白酶活性增加,可破坏组织结构成分,如弹力纤维。③损伤红细胞或其它实质细胞。
当然,血清、组织液和靶细胞亦有抗氧化保护机制,故是否引起损伤取决于两者之间的平衡状态。
2)中性粒细胞溶酶体成分:因中性粒细胞的死亡、吞噬泡形成过程中的外溢及出胞作用,溶酶体成分可外释,介导急性炎症。其中中性粒细胞蛋白酶,如弹力蛋白酶、胶原酶和组织蛋白酶可介导组织损伤。
阳离子蛋白质具有如下生物活性:①引起肥大细胞脱颗粒而增加血管通透性;②对单核细胞的趋化作用;③起中性和嗜酸性粒细胞游走抑制因子的作用。
(4)细胞因子:细胞因子(cytokines)主要由激活的淋巴细胞和单核细胞产生,可调节其他类型细胞的功能,在细胞免疫反应中起重要作用,在介导炎症反应中亦有重要功能。
IL-1和TNF的分泌可被内毒素、免疫复合物、物理性损伤等多种致炎因子刺激,可通过自分泌、旁分泌和全身作用等方式起作用。特别是它们可促进内皮细胞表达粘附分子,增进白细胞与之粘着。也可以引起急性炎症的发热。TNF还能促进中性粒细胞的聚集和激活间质组织释放蛋白水解酶。IL-8是强有力的中性粒细胞的趋化因子和激活因子(图5-7)。
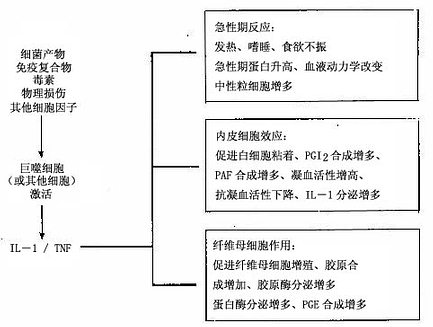
图5-7 IL-1和TNF在炎症中的主要作用
(5)血小板激活因子:血小板激活因子(platelet activating factor,PAF)是另一种磷脂起源的炎症介质,乃由IgE致敏的嗜碱性粒细胞在结合抗原后产生。除了能激活血小板外,PAF可增加血管的通透性、促进白细胞聚焦和粘着,以及趋化作用。此外还具有影响全身血液动力学的功能。嗜碱性粒细胞、中性粒细胞、单核细胞和内皮细胞均能释放PAF。PAF一方面可直接作用于靶细胞,还可刺激细胞合成其他炎症介质,特别是PG和白细胞三烯的合成。
(6)其他炎症介质:P物质可直接和间接刺激肥大胞脱颗粒而引起血管扩张和通透性增加。内皮细胞、巨噬细胞和其他细胞所产生的一氧化氮可引起血管扩张和具细胞毒性。
2.体液中产生的炎症介质血浆中有三种相互关联的系统,即激肽、补体和凝血系统;为重要的炎症介质。
(1)激肽系统:激肽系统的激活最终产生缓激肽(bradykinin),后者可引起细动脉扩张、内皮细胞收缩、细静脉通透性增加,以及血管以外的平滑肌收缩。缓激肽很快被血浆和组织内的激肽酶灭活,其作用主要局限在血管通透性增加的早期。
(2)补体系统;补体系统由一系列蛋白质组成,补体的激活有两种途径—经典和替代途径。在急性炎症的复杂环境中,下列因素可激活补体:①病原微生物的抗原成分与抗体结合通过经典途径激活补体,而革兰氏阴性细菌的内毒素则通过替代途径激活补体。此外,某些细菌所产生的酶也能激活C3和C5。②坏死组织释放的酶能激活C3和C5。③激肽、纤维蛋白形成和降解系统的激活及其产物也能激活补体。
补体可从以下三个方面影响急性炎症:①C3a和C5a(又称过敏毒素)增加血管的通透性,引起血管扩张,都是通过引起肥大细胞和单核细胞进一步释放炎症介质;C5a还能激活花生四烯酸代谢的脂质加氧酶途径,使中性粒细胞和单核细胞进一步释放炎症介质;②C5a引起中性粒细胞粘着于血管内皮细胞,并且是中性粒细胞和单核细胞的趋化因子;③C3b结合于细菌细胞壁时具有调理素作用,可缯强中性粒细胞和单核细胞的吞噬活性,因为在这些吞噬细胞表面有C3b的受体。
C3和C5是最重要的炎症介质。除了前述的激活途径外,C3和C5还能被存在于炎症渗出物中的蛋白水解酶激活,包括纤维蛋白溶酶和溶酶体酶。因此而形成中性粒细胞游出的不休止的环路,即补体对中性粒细胞有趋化作用,中性粒细胞释放的溶酶体又能激活补体。
(3)凝血系统:Ⅻ因子激活不仅能启动激肽系统,而且同时还能启动血液凝固和纤维蛋白溶解两个系统。凝血酶在使纤维蛋白原转化为纤维蛋白的过程中释放纤维蛋白多肽,后者可使血管通透性升高,又是白细胞的趋化因子。

图5-8 激肽、凝血、纤维蛋白溶解及补体的相互作用
纤维蛋白溶解系统可通过激肽系统引起炎症的血管变化。由内皮细胞、白细胞和其他组织产生的纤维蛋白溶酶原激活因子,能使纤维蛋白溶酶原转变成纤维蛋白溶酶,后者通过如下三种反应影响炎症的进程:①通激活第Ⅻ因子启动缓激肽的生成过程;②裂解C3产生C3片断;③降解纤维蛋白产生其裂解产物,进而使血管通透性增加。
炎症介质的作用有两点值得注意。第一,不同介质系统相互之间有着密切的联系,例如图5-8所示的补体、激肽及凝血系统和纤维蛋白溶解系统的激活和其产物的密切关系,便是例证。这些炎症介质的作用也是交织在一起的。第二,几乎所有介质均处于灵敏的调控和平衡体系中。一方面在细胞内处于严密隔离状态的介质,或在血浆和组织内处于前体状态的介质,都必须经过许多步骤才能被激活,在其转化过程中,限速机制控制着产生介质的生化反应的速度。另一方面,介质一旦被激活和被释放,将迅速被灭活或破坏。机体就是通过这种调控体系使体内介质处于动态平衡。
主要炎症介质的的作用小结于表5-1。
表5-1 主要炎症介质的作用
功 能 |
炎症介质种类 |
| 血管扩张 | 组胺、缓激肽、PGI2、PGE2、PGD2、PGF2α |
| 血管通透性升高 | 组胺、缓激肽、C3a、C5a白细胞三烯C4、D4、E4、PAF、活性氧代谢产物 |
| 趋化作用 | 白细胞三烯B4、C5a、细菌产物、中性粒细胞阳离子蛋白细胞因子(IL-8、TNF) |
| 发热 | 细胞因子(IL-1、TNF) |
| 疼痛 | PGE2、缓激肽 |
| 组织损伤 | 氧自由基、溶酶体酶 |
五、急性炎症的类型
由于致炎因子的不同、组织反应轻重程度的不同和炎症的发生部位不同,急性炎症的病理形态也不同。根据渗出物的主要成分,急性炎症分为浆液性炎、纤维素性炎、化脓性炎和出血性炎。
1.浆液性炎症 浆液性炎(serous inflammation)以血清渗出为其特征,渗出的主要成分为浆液,其中混有少量白细胞和纤维素。浆液内含有3%~5%的蛋白质,主要是白蛋白。浆液性炎常发生于疏松结缔组织、浆膜和粘膜等处。浆液性渗出物弥漫地浸润于组织内,局部出现明显的炎性水肿,如毒蛇咬伤、皮肤二度烧伤时渗出液蓄积于表皮内,形成水疱。体腔的浆液性炎造成炎性积液,浆液不仅来自血管渗出,而且也来自间皮细胞的分泌增加,如结核性胸膜炎、风湿性关节炎等。粘膜的浆液性炎又称浆液性卡他,如见于感冒初期的鼻炎。卡他(catarrh)一词来自希腊语,是向下滴流的意思。一般用于粘膜的渗出性炎症,形容渗出液较多,沿粘膜表面向外排出。浆膜或粘膜浆液性炎时,间皮或上皮细胞可发生变性、坏死和脱落。
浆液性炎一般较轻,易于消退。但有时因浆液渗出过多可导致严重后果,如胸腔和心包腔内有大量浆液时,可影响呼吸和心功能。
2.纤维素性炎症 纤维素性炎症(fibrinous inflammation)时以纤维蛋白原渗出并在炎症灶内形成纤维素为主。光镜下,苏木素伊红染色可见大量红染的纤维素交织呈网状,间隙中有中性粒细胞及坏死细胞的碎屑。大片纤维素在镜下表现为片状、红染、质地均匀的物质。纤维蛋白原的大量渗出,说明血管壁损伤较重,多由于某些细菌毒素(如白喉杆菌、痢疾杆菌和肺炎双球菌的毒素)或各种内源性或外源性毒物质(如尿毒症时的尿素和汞中毒)所引起。病变常发生于粘膜、浆膜和肺。在粘膜的纤维素性炎(如白喉、细菌性痢疾),纤维素、白细胞和坏死的粘膜上皮常混合在一起,形成灰白色的膜状物,称为假膜。因此,粘膜的纤维素性炎又称为假膜性炎(图5-9,图5-10)。由于局部组织结构的特点不同,有的假膜牢固附着于粘膜面不易脱落(如咽白喉),有的假膜却与粘膜损伤部联系松散,容易脱落(如气管白喉),脱落的假膜可堵塞支气管而引起窒息。浆膜的纤维素性炎常见于胸膜腔和心包腔,如肺炎双球菌引起的纤维素性胸膜炎及风湿性心包炎。在心包的纤维素性炎时,由于心脏的搏动,使心外膜上的纤维素形成无数绒毛状物,覆盖于心表面,因而又有“绒毛心”之称。此外,大叶性肺炎的红色和灰色肝样变期均有大量纤维蛋白原渗出。
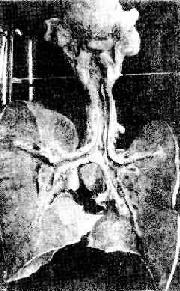
图5-9 白喉
咽喉及气管和支气管粘膜表面有假膜覆盖

图5-10 纤维素性胸膜炎
胸膜表面覆盖大量纤维素性渗出物
少量的纤维素可以被中性粒细胞释放的溶蛋白酶溶解吸收。但是,正常血清和组织中含有一定量的抗胰蛋白酶,这就在一定程度上对抗中性粒细胞溶蛋白酶的作用。因此,如果纤维素较多,加之中性粒细胞所释出的溶蛋白酶较少或组织内抗胰蛋白酶较多时,纤维素不可能被完全溶解吸收,结果发生机化(organization),引起浆膜增厚和粘连,甚至浆膜腔闭锁,严重影响器官功能。
3.化脓性炎症 化脓性炎症(suppurative or purulent inflammation)以中性粒细胞大量渗出,并伴有不同程度的组织坏死和脓液形成为特征。多由葡萄球菌、链球菌、脑膜炎双球菌、大肠杆菌等化脓菌引起,亦可因某些化学物质(如松节油)和机体坏死组织所致。临床上常见的化脓性炎症有疖、痈、化脓性阑尾炎和化脓性脑膜炎等。脓性渗出物称为脓液(pus),是一种混浊的凝乳状液体,呈灰黄色或黄绿色。由葡萄球菌引起的脓液,其质浓稠,而由链球菌引起的脓液,则较稀薄。脓液中的中性粒细胞除少数仍可保持其吞噬能力外,大多数已发生变性和坏死,即变为脓细胞。脓液中除脓细胞外,还含有细菌、被溶解的坏死组织碎屑和少量浆液。根据化脓性炎症发生的原因和部位的不同,可将其分为下列三类。
(1)表面化脓和积脓:表面化脓是指浆膜或粘膜组织的化脓性炎。粘膜化脓性炎又称脓性卡他。此时,中性粒细胞主要向粘膜表面渗出,深部组织没有明显的炎性细胞浸润,如化脓性尿道炎或化脓性支气管炎,渗出的脓液可通过尿道、气管而排出体外。当这种病变发生在浆膜或胆囊、输卵管的粘膜时,脓液则在浆膜腔或胆囊、输卵管腔内蓄积,称为积脓(empyema)。
(2)蜂窝织炎(phlegmonous inflammation):疏松组织中弥慢性化脓称为蜂窝织炎,常见于皮肤、肌肉和阑尾(图5-11)。蜂窝织炎主要由溶血性链球菌引起。链球菌能分泌透明质酸酶,降解结缔组织基质的透明质酸;分泌链激酶,溶解纤维素。因此,细菌易于通过组织间隙和淋巴管蔓延扩散造成弥漫性浸润。
(3)脓肿(abscess):为局限性化脓性炎症,主要特征为组织发生坏死溶解,形成充满脓液的腔,称为脓肿(图5-12,图5-13)。可发生在皮下或内脏,常由金黄色葡萄球菌引起。这些细菌能产生毒素使局部组织坏死,继而大量中性粒细胞浸润,以后粒细胞崩解释出酶将坏死组织液化,形成含有脓液的空腔。金黄色葡萄球菌还产生血浆凝固酶,能使渗出的纤维蛋白原转变为纤维素,因而病变比较局限。最近发现,金黄色葡萄球菌有层粘连蛋白受体,因而容易通过血管壁并引起转移性脓肿。小脓肿可以吸收消散,较大脓肿则由于脓液过多,吸收困难,需要切开排脓或穿刺抽脓,而后由肉芽组织修复,形成瘢痕。
疖是毛囊、皮脂腺及其附近组织所发生的脓肿。疖中心部分液化、变软后,脓肿就可以穿破。痈是多个疖的融集,在皮下脂肪、筋膜组织中形成的许多互相沟通的脓肿,必须及时切开引流排脓后,局部才能修复愈合。在皮肤或粘膜的化脓性炎时,由于皮肤或粘膜坏死、崩解脱落,可形成局部缺陷,即溃疡(ulcer)。深部脓肿如向体表或自然管道穿破,可形成窦道(sinus)或瘘管(fistula)。窦道是指只有一个开口的病理性盲管,瘘管是指连接于体外与有腔器官之间或两个有腔器官之间的、有两个以上开口的病理性管道。例如肛门周围组织的脓肿,可向皮肤穿破,形成脓性窦道,也可既向皮肤穿破,又向肛管穿破,形成脓性瘘管。脓性窦道或脓性瘘管不断排出脓性渗出物,长期不愈。
4.出血性炎症 出血性炎(hemorrhagic inflammation)不是一种独立的炎症类型,只是当炎症灶内的血管壁损伤较重时,渗出物中才有大量红细胞,形成出血性炎症。常见于流行性出血热,钩端螺旋体病或鼠疫等。
上述各种类型的炎症可单独发生,在有些炎症过程中两种不同类型可以并存,如浆液纤维素性炎或纤维素性化脓性炎等。此外,在炎症发展过程中,一种类型炎症可转变为另一种类型,如从浆液性炎开始,可进一步发展成为纤维素性或化脓性炎。

图5-11 蜂窝织炎性阑尾炎
脓性渗出物弥漫浸润于阑尾的粘膜、粘膜下层、肌层及浆膜层×100
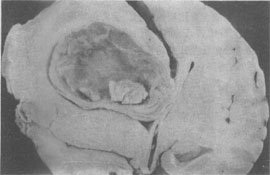
图5-12 脑脓肿
脑实质中有一大脓腔,腔内充满凝乳状脓汁
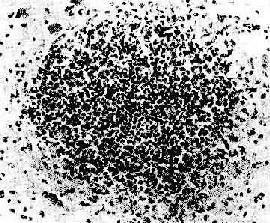
图5-13 脑脓肿
脓肿内脑组织完全坏死、液化,并有大量脓球聚焦×200
六、急性炎症的结局
在炎症过程中,如渗出和增生等抗损伤过程占优势,则炎症逐渐向痊愈方向发展;相反,如损伤性变化占优势,则炎症逐渐加重并可向全身扩散;若损伤和抗损伤变化暂时难分“胜负”,则炎症转变为慢性。
(一)痊愈
大多数炎症病变能够痊愈。
1.完全痊愈在炎症过程中,清除病因,溶解吸收少量的坏死物和渗出物,通过周围健康细胞的再生达到修复,最后完全恢复组织原来的结构和功能。
2.不完全痊愈如炎症灶的坏死范围较广,则由肉芽组织修复,留下瘢痕,不能完全恢复组织原有的结构和功能。
(二)迁延不愈,转为慢性
致炎因子不能在短期内清除、或在机体内持续存在,而且还不断损伤组织,造成炎症过程迁延不愈,急性炎症转化为慢性炎症,病情时轻时重。
(三)蔓延扩散
在病人的抵抗力低下,或病原微生物毒力强、数量多的情况下,病原微生物可不断繁殖并直接沿组织间隙向周围组织、器官蔓延,或向全身扩散。
1.局部蔓延炎症局部的病原微生物可经组织间隙或器官的自然通道向周围组织和器官扩散,如肾结核可沿泌尿道下行播散,引起输尿管和膀胱结核。
2.淋巴道扩散急性炎症时,从血管渗出的含蛋白液体可通过淋巴液回流入血,藉此可减轻或延缓水肿的发生。但在严重损伤的情况下,病原微生物可随淋巴液扩散,引起继发性淋巴管炎及所属淋巴结炎,例如足部感染时,下肢因淋巴管炎可出现红线,腹股沟淋巴结炎表现为局部肿大,并引起疼痛。淋巴道的这些变化有时可限制感染的扩散,但感染严重时,病原体可通过淋巴入血,引起血道扩散。
3.血道扩散炎症灶的病原微生物或某些毒性产物可侵入血循环或被吸收入血,引起菌血症、毒血症、败血症和脓毒性败血症等。
(1)菌血症(bacteremia):细菌由局部病灶入血,但全身并无中毒症状,从血液中可查到细菌,称为菌血症。一些炎症性疾病的早期都有菌血症,如大叶性肺炎等。在菌血症阶段,肝、脾、骨髓的吞噬细胞可组成一道防线,以清除病原体。
(2)毒血症(toxemia):细菌的毒素或毒性产物被吸收入血,为毒血症。临床上出现高热、寒战等中毒症状,同时伴有心、肝、肾等实质细胞的变性或坏死。严重时甚至出现中毒性休克。
(3)败血症(septicemia):毒力强的细菌进入血中不仅未被清除而且还大量繁殖,并产生毒素,引起全身中毒症状和病理变化,称为败血症。患者除有严重的毒血症临床表现外,还常出现皮肤、粘膜的多发性出血班点和脾及全身淋巴结肿大等。此时血液中常可培养出致病菌。
(4)脓毒败血症(pyemia):化脓菌可引起的败血症可进一步发展为脓毒败血症。此时除有败血症的表现外,同时还在一些器官(如肺、肾、肝等)形成多个脓肿。这些脓肿通常较小、较均匀散布在器官中。镜下,脓肿的中央及尚存的毛细血管或小血管中常见到细菌菌落,说明脓肿是由栓塞於器官毛细血管的化脓菌所引起,故称之为栓塞性脓肿(embolicabscess)或转移性脓肿(metastatic abscess)。